Magnesiumnitrat (Mg (NO3) 2) Struktur, egenskaper, användningar

- 890
- 211
- Prof. Erik Johansson
han Magnesiumnitrat Det är ett oorganiskt fasta fastighet vars kemiska formel är mg (nej3)2. Det är en jonisk förening som bildas av föreningen av en MAG -magnesiumkation2+ och två nitratanjoner nej3-.
MG (nej3)2 Det är ett kristallint vitt fast ämne. Det är väldigt hygroskopiskt, det vill säga det absorberar vatten från miljön lätt. Genom att hålla kontakten med miljöns luft tenderar det att bilda sin Mg hexahydrat (nej3)2 •6h2ANTINGEN.
 Mg magnesiumnitrat (nej3)2 pulverlös. Ondřej Mangl [Public Domain]. Källa: Wikimedia Commons.
Mg magnesiumnitrat (nej3)2 pulverlös. Ondřej Mangl [Public Domain]. Källa: Wikimedia Commons. Magnitrathexahydrat (nej3)2 •6h2O Det har i sin kristallina struktur 6 vattenmolekyler h2Eller för varje mg molekyl (nej3)2. Magnesiumnitrat finns i grottor och gruvor i form av nitromagnesitmineral.
MG (nej3)2 Det erhålls kommersiellt genom att reagera Mg -metallen med salpetersyra HNO3.
Det har mycket varierande användningar, såsom jordbruk som gödningsmedel eftersom det ger näringsrika element för växter som kväve (N) och magnesium (MG).
Det används i fyrverkeriindustrin eller pyroteknik och även för att få koncentrerad salpetersyra. Det används i kemisk analys, i fysikexperiment och medicinska och vetenskapliga studier.
[TOC]
Strukturera
Anhydro magnesiumnitrat bildas av en magnesio mg -katjon2+ och två nitratanjoner nej3-.
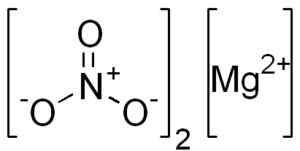 Mg struktur (nej3)2. EDGAR181 [Public Domain]. Källa: Wikimedia Commons.
Mg struktur (nej3)2. EDGAR181 [Public Domain]. Källa: Wikimedia Commons. Magnesio mg jon2+ Den har elektronisk konfiguration: 1s2, 2s2 2 p6, 3s0, Tja, de två elektronerna i det yttersta lagret (3s) har gett. Denna konformation är mycket stabil.
Jonnr3- Den har en platt och symmetrisk struktur.
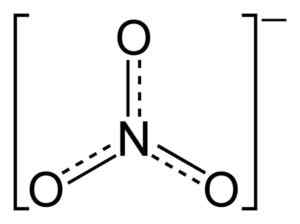 Platt nitratjonstruktur nr3-. De streckade linjerna indikerar en rättvis fördelning av elektroner mellan de tre N-O-bindningarna. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Platt nitratjonstruktur nr3-. De streckade linjerna indikerar en rättvis fördelning av elektroner mellan de tre N-O-bindningarna. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. I strukturen för No3- Den negativa belastningen fördelas kontinuerligt mellan de tre syreatomerna.
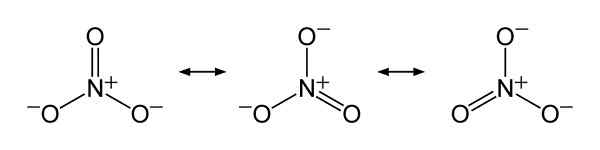 Nitratjonresonansstrukturer nr3-, För att förklara den rättvisa fördelningen av negativ belastning mellan de tre syreatomerna. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Nitratjonresonansstrukturer nr3-, För att förklara den rättvisa fördelningen av negativ belastning mellan de tre syreatomerna. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
-Anhydro magnesiumnitrat: mg (nej3)2
Kan tjäna dig: destillerat vatten-Dihydratiserad magnesiumnitrat: mg (nej3)2 •2h2ANTINGEN
-Hexahydrat magnesiumnitrat: mg (nej3)2 •6h2ANTINGEN
-Magnesiumdinitrat
Egenskaper
Fysiskt tillstånd
-Mg (nej3)2 Vattenfri: Vita fasta, kubiska kristaller.
-Mg (nej3)2 Dihydrado: Kristallint vitt fast ämne.
-Mg (nej3)2 Hexahidered: färglösa fasta, monokliniska kristaller
Molekylvikt
-Mg (nej3)2 Vattenfri: 148,31 g/mol
-Mg (nej3)2 Hexahydrat: 256,41 g/mol
Smältpunkt
-Mg (nej3)2 Hexahydrat: 88,9 ºC
Kokpunkt
-Mg (nej3)2 Hexahydrat: Koka inte, sönderdelas vid 330 ° C
Densitet
-Mg (nej3)2 Vattenfri: 2,32 g/cm3
-Mg (nej3)2 Dihydrared: 1 456 g/cm3
-Mg (nej3)2 Hexahydrat: 1 464 g/cm3
Löslighet
Anhydro magnesiumnitrat är mycket lösligt i vatten: 62,1 g/100 ml vid 0 ºC; 69,5 g/100 ml vid 20 ºC. Det är också mycket hygroskopiskt, att vara i kontakt med luften bildar snabbt hexahydrat.
MG (nej3)2 Dihydrado är också mycket löslig i vatten och etanol. Det är hygroskopiskt.
MG (nej3)2 Hexahydrat är också mycket lösligt i vatten. Det är måttligt lösligt i etanol. Det är den mest stabila av de tre i kontakt med luften, det vill säga av de tre är den som minst absorberar vatten från miljön.
Uppvärmningseffekt
Genom att skicka en vattenlösning av MG (nej3)2 Till indunstning av vatten är saltet som kristalliserar hexahydrat: mg (nej3)2 •6h2ANTINGEN. Hexahydrat betyder att i den fasta mg molekylen (nej3)2 Det är kopplat till 6 vattenmolekyler.
Det finns också mg dihydrat (nej3)2 •2h2Eller, där MG (nej3)2 Solid är fäst vid 2 vattenmolekyler.
Uppvärmning av mg hexahydrat (nej3)2 •6h2Eller anhydra -saltet erhålls inte, eftersom magnesiumnitrat har en hög affinitet för vatten.
Av denna anledning, genom att värma den över sin smältpunkt, ett blandat nitratsalt och magnesiumhydroxid MG (nej3)2 •4 mg (OH)2.
Detta blandade salt, när det når 400 ºC, sönderdelas till magnesiumoxid och lossna kväveoxider gaser.
Det kan tjäna dig: kalciumhypoklorit (CA (CLO) 2)Erhållande
Det kan framställas genom att reagera MGCO -magnesiumkarbonat3 Med salpetersyra hno3, Ge upp koldioxid Co2:
Mgco3 + 2 hno3 → mg (nej3)2 + Co2↑ + H2ANTINGEN
Det kan också erhållas med Mg (OH) magnesiumhydroxid2 och salpetersyra:
Mg (OH)2 + 2 hno3 → mg (nej3)2 + 2 h2ANTINGEN
Kommersiellt erhållet på flera sätt:
1- reagera magnesio mg med salpetersyra hno3.
2- genom reaktion av Mgo magnesiumoxid med salpetersyra HNO3.
3- Gå med i Mg (OH) magnesiumhydroxid2 och NH ammoniumnitrat4NEJ3, Formande magnesiumnitrat med NH ammoniakavskiljning3.
Plats i naturen
MG (nej3)2 Hexahydrat finns naturligtvis i gruvor och grottor eller grottor i form av nitromagnesitmineral.
Detta mineral är närvarande när guano kommer i kontakt med rika stenar i magnesium. Guano är det material som härrör från exkrementet av havsfåglar och tätningar i mycket torra miljöer.
Ansökningar
MG (nej3)2 Hexahydrat används inom keramik-, kemi- och jordbruksindustrin.
Denna förening är en gödningsmedel eftersom den ger kväve (n), som är ett av de tre grundelementen som krävs av växter och magnesium (MG) som också är en sekundär komponent också viktig för dessa.
På detta sätt används det med andra ingredienser i växthus och i hydroponisk kultur. Det senare är att odla växter i en vattenhaltig lösning med gödselsalter istället för jord.
 Hydroponisk kultur. Du kan se kanalerna genom vilka den vattenhaltiga lösningen med gödselsalter såsom Mg magnesiumnitratcirkulat (nej3)2. Författare: Marsraw. Källa: Pixabay.
Hydroponisk kultur. Du kan se kanalerna genom vilka den vattenhaltiga lösningen med gödselsalter såsom Mg magnesiumnitratcirkulat (nej3)2. Författare: Marsraw. Källa: Pixabay. Det används också som en katalysator för att erhålla petrokemiska föreningar. Låter dig justera viskositeten i vissa processer. Anhydro magnesiumnitrat används i pyroteknik, det vill säga för fyrverkerier.
 Fyrverkerier innehåller mg magnesiumnitrat (nej3)2. Författare: Gratis-Goos. Källa: Pixabay.
Fyrverkerier innehåller mg magnesiumnitrat (nej3)2. Författare: Gratis-Goos. Källa: Pixabay. Anhydro magnesiumnitrat är ett dehydratiseringsmedel. Det används till exempel för att erhålla koncentrerad salpetersyra, eftersom det eliminerar vatten och koncentrerar syra ångor upp till 90-95% av HNOS3.
Kan tjäna dig: diagonal regel Koncentrerad salpetersyra. Den ursprungliga uppladdaren var Fabexposive på italienska Wikipedia. [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Källa: Wikimedia Commons.
Koncentrerad salpetersyra. Den ursprungliga uppladdaren var Fabexposive på italienska Wikipedia. [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Källa: Wikimedia Commons. Det används också för att täcka ammoniumnitrat och tillåta bildning av pärlor av nämnda komprimerade material.
Den har användbarhet i bläckformulering, toner (svart pulver som används i fotokopierade system) och färgprodukter. Det fungerar som magnesiumstandard i analytisk kemi.
Magnesium och cerio mg nitratsalt (nej3)2 •Rynka pannan3)3 Det är av intresse för fysikexperiment vid låga temperaturer, eftersom det används som köldmedium i adiabatiska sumagnetiseringsexperiment (utan värmeöverföring).
Detta magnesium- och ceriosalt har använts för att etablera extremt låga temperaturnivåer i Kelvin -skalan (nära Absolute Zero).
I nyligen genomförda studier
Flera forskare har använt MG (nej3)2 I kompositioner med syntetiska och naturliga polymerer för att öka konduktiviteten i magnesiobatterier.
Det har också undersökts i byggandet av Supercaugades för energilagring med hög kraft.
I sjukdomsstudier
Magnesiumnitrat har administrerats till laboratorieråttor med arteriell hypertoni (högt tryck) och det konstaterades att blodtrycket effektivt minskar och dämpar eller mjukar effekterna av komplikationerna av denna sjukdom.
Det har också visat skyddande effekter mot neurologiska störningar (störning i neuroner) och mot döden hos råttor under kaktoneringsprocesser i karotisartären.
Referenser
- Qian, m. et al. (2018). Extrainära porösa få lager kol med hög kapacitans från Pechini-förbränning av magnesiumnitratgel. ACS Appl Mater Interfaces 2018, 10 (1): 381-388. NCBI återhämtade sig.Nlm.Nih.Gov.
- ManJuladevi, r. et al. (2018). En studie på blandningspolymerelektrolyt baserat på poly. Ionics (2018) 24: 3493. Länk återhämtat sig.Kandare.com.
- Kiruthika, s. et al. (2019). Miljövänlig biopolymerelektrolyt, pektin med magnesiumnitratsalt, för applicering i elektokemiska anordningar. J Solid State Electochem (2019) 23: 2181. Länk återhämtat sig.Kandare.com.
- VILSKERTS R. et al. (2014). Magnesiumnitrat dämpar blodtrycket i SHR -råttor. Magnes Res 2014, 27 (1): 16-24. NCBI återhämtade sig.Nlm.Nih.Gov.
- Kuzenkov v.S. och Krushinskii a.L. (2014). Skyddande effekt av magnesiumnitrat mot neurologiska störningar som provoceras av cerebral ischemi hos råttor. Bull Exp Biol Med 2014, 157 (6): 721-3. NCBI återhämtade sig.Nlm.Nih.Gov.
- Ropp, r.C. (2013). Grupp 15 (N, P, AS, SB och Bi) alkaliska jordföreningar. Magnesiumnitrat. I encyklopedi av de alkaliska jordföreningarna. Återhämtat sig från Scientedirect.com.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Volym 1. Fjärde upplagan. John Wiley & Sons.
- ELLER.S. National Library of Medicine. (2019). Magnesiumnitrat. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov.
- « Tekniskt systemkoncept och egenskaper, element, exempel
- Massnummer vad det består av och hur man får det (med exempel) »

