Massnummer vad det består av och hur man får det (med exempel)
- 2604
- 185
- Per Eriksson
han Massnummer o Massantal av en atom är summan av antalet protoner och mängden kärnneutroner. Dessa partiklar betecknas omväxlande med namnet på Nukleoner, Därför representerar massantalet mängden av dem.
Låt n antalet neutroner närvarande och z antalet protoner, om vi kallar hur massantalet, då:
A = n + z
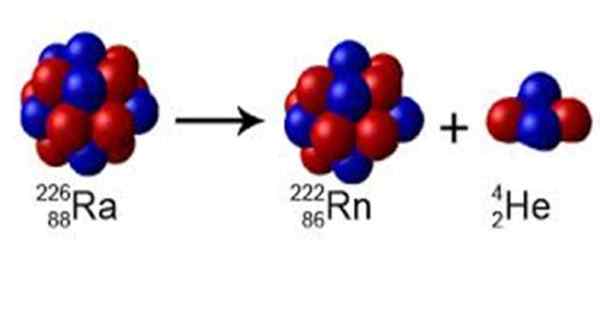
 Figur 1. Radion har ett massnummer A = 226, den sönderfaller till radon med A = 222 och avger en kärna av helium av A = 4. Källa: Wikimedia Commons. Perox [CC0] [TOC]
Figur 1. Radion har ett massnummer A = 226, den sönderfaller till radon med A = 222 och avger en kärna av helium av A = 4. Källa: Wikimedia Commons. Perox [CC0] [TOC]
Exempel på massantal
Omedelbart några exempel på massnummer för välkända element:
Väte
Den mest stabila och rikliga väteatomen är också den enklaste: 1 proton och en elektron. Eftersom vätekärnan inte har några neutroner är det sant att a = z = 1.
Syre
En syrekärna har 8 neutroner och 8 protoner, därför A = 16.
Kol
Livet på jorden är baserat på kolkemi, en lätt atom med 6 protoner i sin kärna plus 6 neutroner, som A = 6 + 6 = 12.
Uran
Detta tunga element än de tidigare är välkänt för sina radioaktiva egenskaper. Uraniumkärnan har 92 protoner och 146 neutroner. Sedan är ditt massnummer A = 92 + 146 = 238.
Hur man får massanumret?
Som sagt tidigare motsvarar massanalet A i ett element alltid summan av antalet protoner och antalet neutroner som innehåller dess kärna. Det är också ett heltal, men ... finns det någon regel när det gäller förhållandet mellan båda mängderna?
Låt oss se: Alla element som nämns ovan är lätta, utom uran. Väteatomen är, som vi sa, det enklaste. Den har inga neutroner, åtminstone i sin vanligaste version, och i syre och kol finns det lika antal protoner och neutroner.
Det kan tjäna dig: vad är utsläppsavträdet? (Med exempel)Det händer också med andra ljuselement, som kväve, en annan mycket viktig gas för livet, som har 7 protoner och 7 neutroner. Men eftersom kärnan är mer komplex och atomer blir tyngre ökar antalet neutroner med en annan rytm.
Till skillnad från lätta element har uran, med 92 protoner, ungefär 1 ½ gånger så mycket i neutroner: 1 ½ x 92 = 1.5 x 92 = 138.
Som ni ser är det ganska nära 146, mängden neutroner den har.
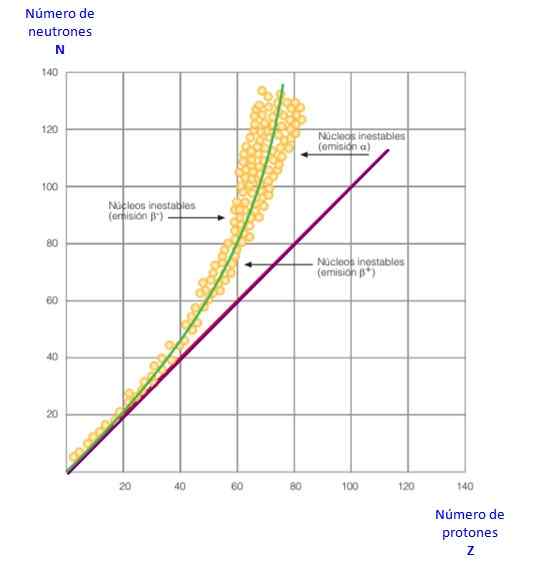 figur 2. Stabilitetskurva. Källa: f. Zapata.
figur 2. Stabilitetskurva. Källa: f. Zapata. Allt detta blir tydligt i kurvan i figur 2. Det är en graf av n kontra z, känd som kärnstabilitetskurva. Där kan man se hur lätta atomer har samma antal protoner som neutron, och hur från z = 20 antalet neutroner ökar.
På detta sätt blir den stora atomen mer stabil, eftersom överskott av neutroner minskar elektrostatisk avstötning mellan protoner.
Atomer
En mycket användbar notation som snabbt beskriver typen av atom är som följer: symbolen för elementet och respektive atom- och massantal skrivs som visas nedan i detta schema:
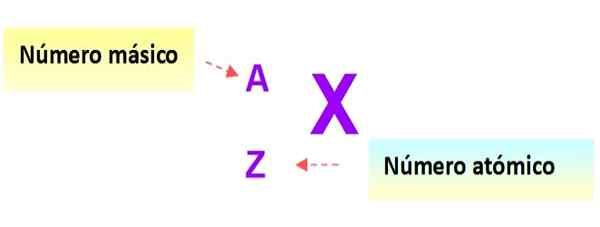 Figur 3. Atomnotation. Källa: f. Zapata.
Figur 3. Atomnotation. Källa: f. Zapata. I denna notation skulle atomerna i de tidigare exemplen vara:

Ibland används en annan bekvämare notation, där endast symbolen för elementet och massantalet för att beteckna atomen används, utelämnande av atomnumret. På detta sätt 12 6C är skriven helt enkelt som kol-12, 16 8Eller det skulle vara syre-16 och så för alla element.
Kan tjäna dig: Semicircle: Hur man beräknar omkretsen, området, centroid, övningarIsotoperna
Antalet protoner i en kärna bestämmer elementets natur. Till exempel är varje atom vars kärna innehåller 29 protoner en kopparatom, vad som än händer.
Anta att en kopparatom tappar en elektron av någon anledning, men det är fortfarande koppar. Men nu är det en joniserad atom.
Det är svårare för en atomkärna att vinna eller förlora en proton, men i naturen kan det inträffa. Till exempel inuti stjärnorna bildas kontinuerligt tyngre element från ljuselement, eftersom stjärnkärnan uppför sig som en fusionsreaktor.
Och här på jorden finns det fenomenet radioaktivt upplösning, där vissa instabila atomer utvisar nukleoner och avger energi och förvandlas till andra element.
Slutligen finns det möjligheten att en atom av ett visst element har ett annat massantal, i detta fall är det en isotop.
Ett bra exempel är den välkända kol-14 eller radiokolon, som används för att träffa arkeologiska föremål och som en biokemisk spårare. Detta är samma kol med identiska kemiska egenskaper, men med två extra neutroner.
Kol-14 är mindre rikligt än kol-12, den stabila isotopen och är också radioaktiv. Detta innebär att det med tiden sönderfaller genom att avge energi och partiklar tills det blir ett stabilt element, vilket i dess fall är kväve.
Kolisotoper
Kol finns i naturen som en blandning av flera isotoper, av vilka den vanligaste är ovannämnda 12 6C eller Carbon-12. Och utöver kol-14 är 13 6C med en extra neutron.
Kan tjäna dig: växlande aktuella kretsar: typer, applikationer, exempelDetta är vanligt i naturen, till exempel tenn, 10 stabila isotoper är kända. Å andra sidan är en enda isotop känd som beryllium och natrium.
Varje isotop, naturlig eller konstgjord, har en annan transformationsrytm. På samma sätt är det möjligt att skapa konstgjorda isotoper i laboratoriet, som vanligtvis är instabila och förfall radioaktivt inom en mycket kort period av andra fraktioner, medan andra tar mycket mer, lika mycket som jordens ålder eller mer.
Naturligt kolisotopbord
| Kolisotoper | Atomantal z | Massnummer a | Överflöd % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.elva |
| 14 6 C | 6 | 14 | Spår |
Löst exempel
- Exempel 1
Vad är skillnaden mellan 13 7 N och 14 7 N?
Svar
Båda är kväveatomer, eftersom deras atomnummer är 7. Emellertid har en av isotoperna, som har A = 13, en mindre neutron, medan 14 7 N är den vanligaste isotopen.
- Exempel 2
Hur många neutroner finns det i kärnan i en kvicksilveratom, betecknad som 201 80 Hg?
Svar
Eftersom a = 201 och z = 80, och också att veta att:
A = z + n
N = a - z = 201 - 80 = 121
Och det dras slutsatsen att kvicksilveratomen har 121 neutroner.
Referenser
- Connor, n. Vad är nukleon - Struktur av atomkärnan - Definition. Hämtad från: periodisk-rabel.org.
- Riddare, r. 2017. Fysik för forskare och teknik: En strategistrategi. Pearson.
- Sears, Zemansky. 2016. Universitetsfysik med modern fysik. 14th. Ed. Volym 2.
- Tippens, s. 2011. Fysik: koncept och applikationer. Sjunde upplagan. McGraw Hill.
- Wikipedia. Massnummer. Hämtad från: i.Wikipedia.org.
- « Magnesiumnitrat (Mg (NO3) 2) Struktur, egenskaper, användningar
- Coplanares punkter Ekvation, exempel och löst övningar »

