Silvernitrat (AGNO3) struktur, egenskaper, användningar, toxicitet

- 2113
- 50
- Per Eriksson
han silvernitrat Det är ett oorganiskt salt vars kemiska formel är agno3. Av alla silversalter är det den mest ekonomiska och den som ger en relativ stabilitet mot solljus, så det tenderar mindre att sönderdelas. Det är den lösliga och predilect silverkällan i varje undervisning eller forskningslaboratorium.
Vid undervisning används vattenhaltiga silvernitratlösningar för att lära utfällningsreaktioner för silverklorid. På samma sätt läggs dessa lösningar i kontakt med metall koppar för att äga rum en Rédox -reaktion, där metallsilveren fälls ut mitt i den bildade upplösningen av kopparnitratet, Cu (nej3)2.
 Silvernitratprovbehållare. Källa: W. Oelen/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Silvernitratprovbehållare. Källa: W. Oelen/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) I den övre bilden visas en flaska med silvernitrat. Det kan hållas utsatt för ljus utan att snart mörkare av dess kristaller, produkten av utseendet på silveroxid.
Efter de alkemiska tullarna och de antibakteriella egenskaperna hos metallsilver har silvernitrat använts för att desinficera och cauterisera sår. För detta ändamål används emellertid mycket utspädda vattenlösningar, eller dess fasta blandade med kaliumnitrat appliceras av spetsen av trästänger.
[TOC]
Silvernitratstruktur
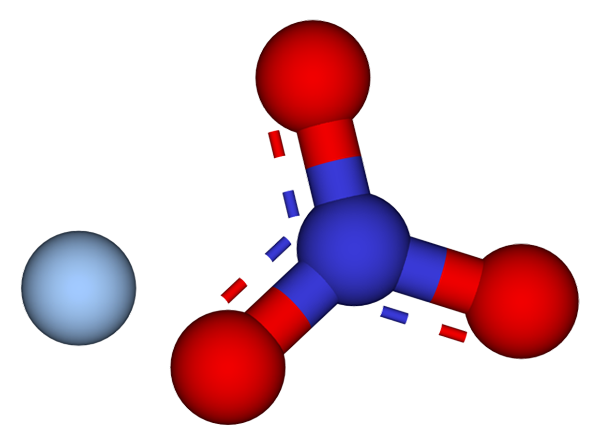 Joner som utgör silvernitratkristallerna. Källa: CCOIL/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0)
Joner som utgör silvernitratkristallerna. Källa: CCOIL/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0) I den övre bilden visas agjonerna+ och inte3- av silvernitrat, som representeras av en modell av sfärer och staplar. Agno -formeln3 indikerar den stökiometriska andelen av detta salt: för varje katjon Ag+ Det finns en anjon inte3- interagerar med honom elektrostatiskt.
Det kan tjäna dig: svavel: historia, egenskaper, struktur, erhållning, användningAnjonen3- (av röda och blåaktiga sfärer) har en trigonal platt geometri, med den negativa belastningen som återkallas mellan dess tre syreatomer. Därför sker elektrostatiska interaktioner mellan de två jonerna specifikt mellan katjonen+ Och en syreatom i anjonen gör det inte3- (Ag+-ELLER INTE2-).
På detta sätt varje ag+ slutar med att samordna eller omge tre nej3- intill samma plan eller kristallografiskt lager. Grupperingen av dessa plan slutar definiera en kristall vars struktur är ortorrombisk.
Förberedelse
Silvernitrat framställs genom att attackera ett förbränt metall silverstycke med salpetersyra, vare sig det är kallt eller varm koncentrerad:
3 AG + 4 HNO3 (utspädd) → 3 Agno3 + 2 h2O +nej
AG + 2 HNO3 (koncentrerad) → Agno3 + H2O +nej2
Notera bildningen av gaser nej och inte2, som är giftiga och tvingar denna reaktion som inte genomförs utanför en extraktorklocka.
Fysiska och kemiska egenskaper
Fysiskt utseende
Färglöst kristallint fast, toalett, men mycket bitter smak.
Molmassa
169,872 g/mol
Smältpunkt
209,7 ºC
Kokpunkt
440 ºC. Vid denna temperatur lider emellertid en termisk nedbrytning, där metallsilver inträffar:
2 agno3(l) → 2 Ag (S) + O2 (g) + 2 nej2 (g)
Det finns inga Agno -ångor3, Åtminstone inte under markförhållanden.
Löslighet
Agno3 Det är en oerhört löslig vattenbesparing, med en löslighet på 256 g/ 100 ml vid 25 ° C. Det är också lösligt i andra polära lösningsmedel såsom ammoniak, ättiksyra, aceton, eter och glycerol.
Densitet
4,35 g/cm3 vid 24 ºC (omgivningstemperatur)
Kan tjäna dig: destillerat vatten3,97 g/cm3 vid 210 ºC (bara vid smältpunkten)
Stabilitet
Agno3 Det är ett stabilt ämne när det lagras korrekt. Det kommer inte att bli inflammerat vid någon temperatur, även om det kan brytas ner genom att frigöra kväveoxider giftiga ångor.
Å andra sidan, även om silvernitrat inte är brandfarligt, är det ett kraftfullt oxidationsmedel som, när man kommer i kontakt med organiskt material och en värmekälla, kan utlösa en exoterm och explosiv reaktion.
Utöver detta bör detta salt inte utsättas för mycket tid för solljus, eftersom deras kristaller är mörkare på grund av bildandet av silveroxid.
Silvernitratanvändning
Utfällande och analytisk agent
I föregående avsnitt gjordes omnämnandet av den otroliga lösligheten hos Agno3 I vatten. Detta innebär att agjoner+ De kommer att lösa upp utan problem och kommer att vara tillgängliga för att interagera med någon vattenhaltig mediumjon, såsom halogenidanjoner (x = f-, Kli-, Bras- och jag-).
Silver som AG+, Och efter tillägget av HNO3 utspädd, fäller ut fluorider, klorider, bromider och jodider, som består av vita eller gulaktiga fasta ämnen:
Ag+(ac) +x-(AC) → AGX (S)
Denna teknik är mycket återkommande för att erhålla halogenuros och används också i många kvantitativa analysmetoder.
Tullreagens
Agno3 Det spelar också en analytisk roll i organisk kemi, eftersom det är det huvudsakliga reagenset, bredvid ammoniak, för beredningen av tollens reagens. Detta reagens används i kvalitativa studier som gör det möjligt att bestämma närvaron av aldehyder och ketoner i ett problemprov.
Syntes
Agno3 Det är en utmärkt löslig silverjonkälla. Detta, utöver dess relativa och låga kostnad, gör det till ett begärt reagens för otaliga organiska och oorganiska syntes.
Det kan tjäna dig: Gibbs Free Energy: Enheter, hur det beräknas, lösta övningarOavsett reaktion, om du behöver agjoner+, Så det är ganska troligt att kemikalier tar till AGNO3.
Medicinsk
Agno3 Han hade mycket popularitet inom medicinen innan modern antibiotika utseende. Idag används det dock fortfarande för specifika fall, eftersom det har caulster och antibakteriella egenskaper.
Vanligtvis är det blandat med KNO3 Vid spetsen av trästavar, så att den uteslutande reserveras för aktuella användningar. I detta avseende har det tjänat för behandling av vårtor, sår, infekterade naglar, nasala munnsår och blödning. Agno -blandningen3-Kno3 Cauteriza Huden förstör skadad vävnad och bakterier.
AGNO: s bakteriedödande verkan3 Det har också använts vid vattenrening.
Toxicitet och biverkningar
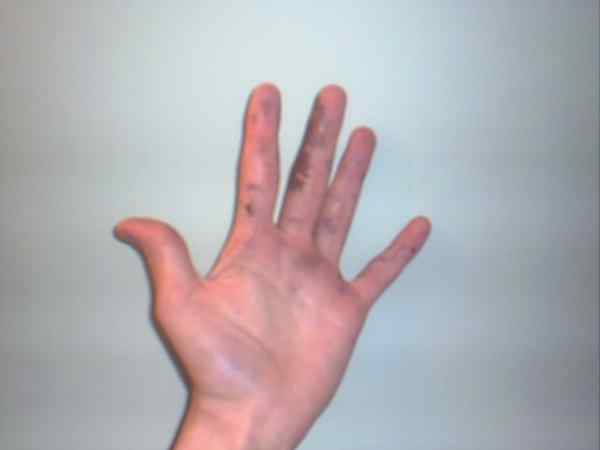 Silvernitrat kan orsaka brännskador som visas av deras lila eller mörka fläckar. Källa: Jane of Baden på English Wikipedia / Public Domain
Silvernitrat kan orsaka brännskador som visas av deras lila eller mörka fläckar. Källa: Jane of Baden på English Wikipedia / Public Domain Även om silvernitrat är en stabil lön och inte representerar för många risker, är det ett mycket kaustiskt fast ämne, vars intag kan orsaka allvarlig gastrointestinal skada.
Det är därför dess manipulation med handskar rekommenderas. Det kan bränna huden, och i vissa fall mörknar den tills den blir lila, tillstånd eller sjukdom som kallas Argiria.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Silvernitrat. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Silvernitrat. Pubchemdatabas., CID = 24470. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Elsevier b.V. (2020). Silvernitrat. Vetenskaplig. Hämtad från: Scientedirect.com
- University of Iowa. (2020). Silvernitratanvändning och toxicitet. Återhämtat sig från: medicin.Uiowa.Edu
- P.F. Lindley & P. Trä. (1966). En X-Ray Research of Silver Nitrate: En unik metallnitratstruktur. Journal of the Chemical Society A: Oorganisk, fysisk, teoretisk.
- Lucy Bell Young. (2020). Vad är den medicinska användningen av silvernitrat. Reagenskemikalier. Återhämtat sig från: kemikalier.co.Storbritannien

