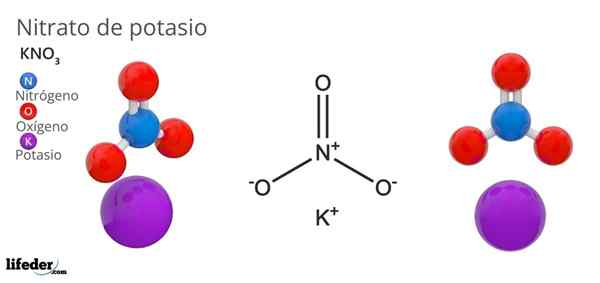
Kaliumnitrat (KNO3)
- 4536
- 116
- Per Eriksson
Vad är kaliumnitrat?
han kaliumnitrat Det är ett ternärt salt bestående av kalium, alkalisk metall och nitratoxoanion. Dess kemiska formel är Kno3, Vilket betyder att för varje kjon+, Det finns ingen jon3-- interagerar med detta. Därför är det ett joniskt salt och utgör en av de alkaliska nitraterna (lino3, Äldre bror3, Rbno3...).
Kno3 Det är ett starkt oxidationsmedel på grund av närvaron av nitratanjon. Det vill säga det fungerar som en reserv av fasta nitratjoner, till skillnad från andra mycket lösliga salter i vatten eller mycket hygroskopiskt. Många av egenskaperna och användningen av denna förening beror på nitratanjonen snarare än kaliumkatjonen.
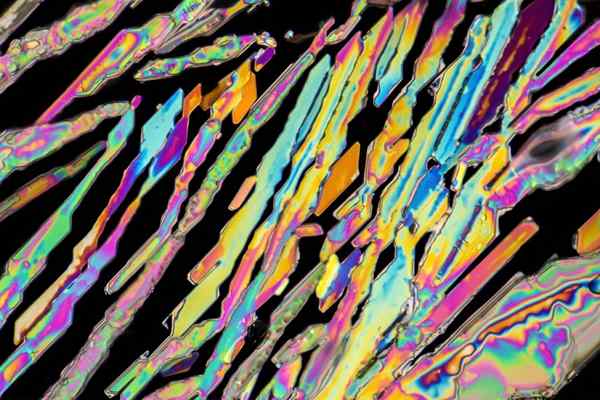 Kaliumnitratkristaller
Kaliumnitratkristaller I den övre bilden illustreras vissa kristaller av KNO3 med nålformer. Den naturliga källan till Kno3 är saltpetern, känd som namnen Salpeter antingen Ballong, på engelska. Detta element är också känt som potassa nitrat eller nitro mineral.
Det ligger i torra eller ökenområden, liksom utsläpp av de kavernösa väggarna. En annan viktig källa till KNO3 Det är guano, exkrement av djur som bor torra miljöer.
Kemisk struktur av kaliumnitrat
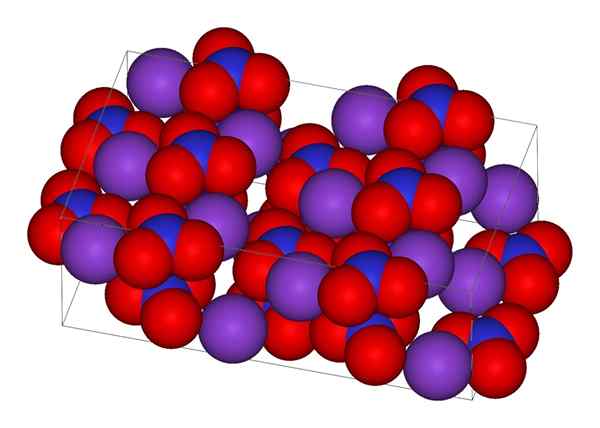 Kristallin struktur av kaliumnitrat
Kristallin struktur av kaliumnitrat I den övre bilden representeras den kristallina strukturen i KNO3. Lila sfärer motsvarar K -joner+, Medan rött och blått är syre- och kväveatomer. Den kristallina strukturen är ortorrombisk vid rumstemperatur.
Nion geometri nr3- Det är det för ett trigonalt plan, med syreatomerna i triangelns toppar och kväveatomen i centrum. Den ger en positiv formell belastning i kväveatomen och två negativa formella belastningar i två syreatomer (1-2 = (-1)).
Kan tjäna dig: Enkelt mikroskopDessa två negativa avgifter för nej3- De flyttar mellan de tre syreatomerna och bibehåller alltid den positiva belastningen i kväve. Som en följd av ovanstående, kjoner-+ av kristallen undviker de att vara strax över eller under kvävet i anjonerna inte3-.
Faktum är att bilden visar hur kjoner+ De är omgiven av syreatomer, röda sfärer. Sammanfattningsvis är dessa interaktioner ansvariga för kristallina arrangemang.
Andra kristallina faser
Variabler som tryck och temperatur kan modifiera dessa arrangemang och orsaka olika strukturella faser för KNO3 (Faser I, II och III). Till exempel är fas II den för bilden, medan fas I (med trigonal kristallin struktur) bildas när kristallerna värms upp till 129 ºC.
Fas III är ett övergångsfast som erhålls från kylning av fas I, och vissa studier har visat att det uppvisar några viktiga fysiska egenskaper, såsom ferroelektricitet. I denna fas bildar kristallen kaliumskikt och nitrater, eventuellt känsliga för elektrostatiska repulsioner mellan joner.
I lagren av fas III är anjonerna nr3- De förlorar lite av sin planaritet (triangelkurvorna något) för att tillåta detta arrangemang, som före någon mekanisk störning blir strukturen för fas II.
Kaliumnitratanvändning/applikationer
Salt är av stor betydelse, eftersom det används i många människos aktiviteter, som manifesteras inom industri, jordbruk, mat etc. Dessa användningsområden inkluderar följande:
- Matbevarande, särskilt kött. Trots misstanken att den ingriper i bildningen av nitrosamin (cancerframkallande medel) används fortfarande i charcuterie.
- Gödningsmedel, eftersom kaliumnitrat tillhandahåller två av de tre växternas makronäringsämnen: kväve och kalium. Tillsammans med fosfor är detta element nödvändigt för utvecklingen av växter. Det vill säga det är en viktig och hanterbar reserv för dessa näringsämnen.
- Accelererar förbränning och kan producera explosioner om det brännbara materialet är omfattande eller om det är fint uppdelat (större ytarea, större reaktivitet). Dessutom är det en av de viktigaste komponenterna i krutt.
- Underlättar borttagandet av beröringen av de högkallade träden. Nitrat levererar det kväve som är nödvändigt för att svampar ska förstöra stubbens trä.
- Det ingriper i minskningen av tandkänslighet genom dess införlivande i tandläkare, vilket ökar skyddet av smärtsamma känslor av tand som produceras av kall, värme, syra, godis eller kontakt.
- Ingriper som en hypotensor i regleringen av blodtrycket hos människor. Denna effekt skulle ges eller sammanhängande med en förändring av natriumutskillnad. Den rekommenderade dosen i behandlingen är 40-80 meq/dag kalium. I detta avseende påpekas det att kaliumnitrat skulle ha diuretiska verkan.
Syntes
Det mesta av nitratet produceras i gruvorna på öknarna i Chile. Det kan syntetiseras genom flera reaktioner:
Nh4NEJ3 (AC) +KOH (AC) => NH3 (AC) +KNO3 (Ac)+h2Eller (l)
Kaliumnitrat neutraliserande salpetersyra med kaliumhydroxid i en mycket exoterm reaktion.
Koh (ac) +hno3(conc) => Kno3 (Ac) +h2Eller (l)
I industriell skala produceras kaliumnitrat genom en dubbel förskjutningsreaktion.
Äldre bror3 (AC) +KCl (AC) => NaCl (AC) +KNO3 (Ac)
Den huvudsakliga källan till KCL är från Silvina Mineral, och inte andra mineraler som karnalit eller kainit, som också består av jonisk magnesium.
Fysiska och kemiska egenskaper
Kaliumnitrat i fast tillstånd presenteras som en vit eller i form av ortorombiska strukturkristaller vid omgivningstemperatur och trigonal vid 129 ºC. Den har en molekylvikt på 101.1032 g/mol, den är toalett och har en saltlösning.
Det är en mycket löslig förening i vatten (316-320 g/liter vatten, vid 20 ° C) på grund av dess joniska natur och lätthet av vattenmolekyler för att lösa kjonen K+.
Dess densitet är 2,1 g/cm3 vid 25 ºC. Detta innebär att det är ungefär två gånger tätt än vatten.
Dess smältpunkter (334 ºC) och kokning (400 ºC) indikerar de joniska bindningarna mellan K+ och inte3-. De är emellertid låga jämfört med de hos andra salter, eftersom kristallin retikulär energi är lägre för monovalenta joner (det vill säga med belastningar ± 1) och inte heller har så lika storlekar.
Kan tjäna dig: pH -indikatorerDen sönderdelas vid en temperatur nära kokpunkten (400 ° C) för att producera kalium och molekylärt syre:
Kno3(S) => Kno2(S) + eller2(g)
Referenser
- Pub. (2018). Kaliumnitrat. Återhämtat sig från pubchem.Ncbi.Nlm.Nik.Gov
- Kristall. (2009). Tillväxt och enkristallförfining av fas-III kaliumnitrat, KNO3. B65, 659-663.
- Marni Wolfe. (3 oktober 2017). Kaliumnitratrisker. Livestrong återhämtade sig.com
- Amethyst Galleries, Inc. (1995-2014). Mineralniten. Gallerier återhämtade sig.com