Nitraternas egenskaper, struktur, nomenklatur, träning
- 3457
- 510
- Johan Johansson
De Nitrater De är alla de föreningar som inte innehåller anjon3-, När det gäller oorganiska salter, eller nitro -gruppen, -ono2, När det gäller organiska derivat. I oorganiska är alla nitrater metallsalter eller ammoniumjon, där elektrostatiska interaktioner M dominerarn+NEJ3-.
Till exempel natriumnitrat3, Det bildas av Na -joner+ och inte3-. Detta salt, tillsammans med kaliumnitrat, Kno3, är de vanligaste nitraternas exemplar i naturen. Nitrater hittar i jorden, i växtvävnader, och framför allt, i hav och saltlösningar som saliter, belägna i Chile.
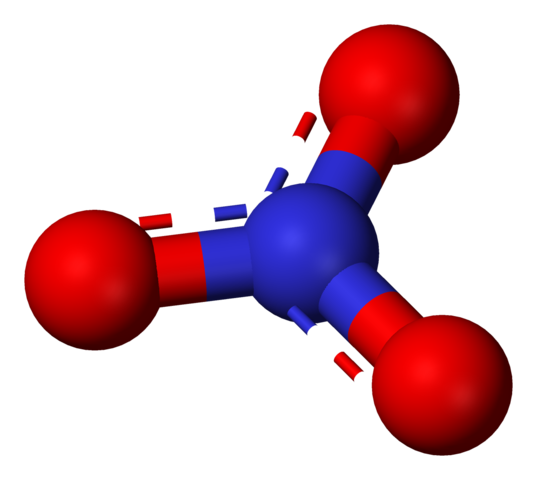
 Nitratanjon representerad av en sfärer och staplarmodell. Källa: Benjah-Bmm27 / Public Domain.
Nitratanjon representerad av en sfärer och staplarmodell. Källa: Benjah-Bmm27 / Public Domain. Termen "nitrater" hänvisar omedelbart till salter, gödselmedel och sprängämnen. De är också relaterade till kött och deras härdningsprocesser för att hämma tillväxten av bakterier och därmed försena deras försämring. Nitrater är också synonymer för grönsaker, eftersom de innehåller stora mängder av dessa salter.
Han gör inte3- (överlägsen bild) är den mest oxiderade formen av kväve, som är den slutliga och assimilerbara produkten från dess biologiska cykel. Atmosfärens kväve lider av flera transformationer, antingen av arbetet med elektriska strålar eller genom mikrobiella åtgärder, att bli NH4+ och inte3-, både lösliga i vatten och absorberar av växter.
Nitrater används som oxidationsmedel, gödselmedel, sprängämnen och kardiologiska mediciner. Denna sista användning kontrasterar mycket med andra, eftersom de metaboliserar eller interagerar med kroppen på ett sådant sätt att de utvidgar vener och artärer; Och därför är det en ökning och förbättring av blodflödet, vilket lindrar hjärtsmärtor.
[TOC]
Nitrateregenskaper
Neutralitet
Nitrater är i princip neutrala ämnen, som nej3- Det är den konjugerade basen av salpetersyra, HNO3, En stark syra. I vatten är det inte märkbart:
NEJ3- + H2Eller ⇌ hno3 + Åh-
I själva verket kan det sägas att denna hydrolys inte förekommer alls, mängderna av Oh är föraktligt-. Därför är vattenhaltiga nitratlösningar neutrala om det inte finns andra upplösta ämnen.
Fysiska uppträdanden
Oorganiska nitrater består av salter vars allmänna formler är m (nej3)n, varelse n Det är Valencia eller en positiv belastning av den metalliska katjonen. Alla dessa nitrater har kristallin ljusstyrka och har vitaktiga färger. Övergångsmetallnitrater kan dock vara färgglada.
Till exempel kopparnitrat (II) eller cupric nitrat, Cu (Nej3)2, Det är ett blåaktigt kristallint fast ämne. Under tiden nickelnitrat (II), inte heller (nej3)2, Det är en solid smaragdfärg. Några andra nitrater, såsom järn, presenterar svaga färger.
Å andra sidan är organiska nitrater vanligtvis mycket känsliga och explosiva fasta ämnen eller fasta ämnen.
Det kan tjäna dig: levande materia: koncept, egenskaper och exempelTermisk nedbrytning
Metallnitrater är känsliga för höga temperaturer, eftersom de börjar bryta ner enligt följande kemiska ekvation:
2m (nej3)2(S) → 2mo (S)+4NO2(g)+eller2(g)
Som observerats sönderdelas metallnitrat till en oxid-, MO- och kväve- och syredioxid. Denna termiska nedbrytning förekommer inte vid samma temperatur för alla nitrater; Vissa motstår mer än andra.
Som en allmän regel är ju större och mindre belastningen av katjon M+, Större är den temperatur vid vilken nitrat måste värmas upp för att bryta ner. Istället, när m+ Den är liten eller har en stor positiv belastning, nitrat sönderdelas vid lägre temperaturer, därför mer instabil.
Till exempel natriumnitrat3, Det sönderdelas vid en temperatur som är lägre än för bariumnitrat, BA (nej3)2, Tja, även om BA2+ har större belastning än na+, Dess storlek är mycket större.
Oxiderande medel
Han gör inte3- Det är en relativt stabil anjon. Emellertid är dess kväveatom starkt oxiderad, med ett oxidationstillstånd på +5 (N5+ANTINGEN32-), Så det är "törstig" av elektroner. Av denna anledning är nitrat ett oxiderande medel, som kommer att försöka rycka ämnen elektroner runt det.
Det är denna brist på elektroner i kväveatomen i NO3- Vad nano gör3 Och Kno3 Starka oxiderande medel, används som kruttkomponenter. Tillägg till denna egenskap det faktum att gaser släpps2 Jag2 När det sönderdelas, förstås det varför det är en del av många sprängämnen.
När nitrat får elektroner eller minskar kan det omvandlas till ammoniak, NH3, eller i kväveoxid, nej, beroende på reagens och förhållanden.
Löslighet
Alla oorganiska nitrater, eller vad som är samma, metall- och ammoniumnitrater, NH4NEJ3, De är vattenlösliga föreningar. Detta beror på att vattenmolekyler har en stark affinitet för inte3-, Och att de kristallina nätverken för dessa nitrater inte är särskilt stabila.
Strukturera
Nitratanjon
 Nitratresonansstrukturer. Källa: Benjah-Bmm27 / Public Domain.
Nitratresonansstrukturer. Källa: Benjah-Bmm27 / Public Domain. Den övre bilden visar resonansstrukturerna för nitratanjonen. Som framgår finns två negativa laddningar i två syreatomer, som demokaliseras mellan de tre syreatomerna. Därför har var och en en belastning på -2/3, medan kväve har en +1 belastning.
Så, nej3- Interaktion elektrostatiskt, eller formar koordinationslänkar, genom någon av dess tre syreatomer.
Fasta ämnen
Alla oorganiska nitrater är saltlösning och joniska. Därför är dess strukturer kristallina, vilket innebär att dess joner, m+ och inte3-, De är ordnade i rymden tack vare deras elektrostatiska interaktioner. Beroende på dessa interaktioner kommer deras kristaller att presentera olika strukturer.
Kan tjäna dig: vad är säkerheten romb och vad är det för?Till exempel Nanos kristallina struktur3 Det är trigonal eller rhomboédica, medan den för Kno3 Det är ortorrombiskt.
Organiska nitrater
Organiska nitrater representeras med den allmänna formeln Rono2, där r är en alkyl eller aromatisk grupp. Dessa föreningar kännetecknas av deras R-AON-länk2, och består vanligtvis av kvävederivat av polymerer och andra organiska ämnen.
Komplex
Han gör inte3- Det koordinerar med metallcentra för att bilda en M -länk+-ELLER INTE2-, Att vara en annan interaktion mot jonisk. Dessa komplex är i huvudsak oorganisk natur. Nitrat kan till och med koordineras med två av sina syreatomer samtidigt, m+-ANTINGEN2NEJ.
Nomenklatur
För att utse en nitrat måste orden 'nitrat av' följt av namnet på katjonen eller gruppen som åtföljer den i deras respektive kemiska formel skrivas först. Valencia för katjonen anges i parentes när den har mer än en. På samma sätt kan suffix användas -CO och -OY om så föredras, efter den traditionella nomenklaturen.
Tänk till exempel på tro (nej3)3. Namnet är järnnitrat (iii), eftersom dess valens är +3, eller kan också kallas järnnitrat.
Dessa regler gäller också för organiska nitrater, förutsatt att deras strukturer är enkla. Till exempel Cho3ELLER INTE2 Det kallas metylnitrat, eftersom -ch -gruppen3 Det blir R -gruppen som följer med -ono2.
Träning
Naturlig
Nitrater bildas i naturen som en del av den biologiska cykeln av kväve. På grund av detta har jordarna, haven och vissa vattenströmmar betydande mängder nitrater. Beroende på de omgivande jonerna kommer olika nitratsalter att bildas, att vara nano3 Och Kno3 Det vanligaste och rikliga.
Industriell
Nitrater bildas vid industriella skalor genom neutralisering av salpetersyra, antingen med metallhydroxider, alkoholer, polymerer etc. Till exempel kalciumnitrat, CA (nej3)2, Det kan framställas enligt följande kemiska ekvation:
Ca (oh)2 + 2hno3 → CA (nej3)2 + 2h2ANTINGEN
På liknande sätt attackeras flera organiska ämnen av HNO3 under vissa förhållanden för att främja ersättningen av några av deras grupper med -ono2. Detta är vad som händer med reaktionen från cellulosa för att förvandlas till nitrocellulosa eller cellulosanitrat, ett polymeriskt och explosivt material.
Fotokatalytisk
Anjonen3-, Och därför kan oorganiska nitrater bildas genom den fotokatalytiska verkan av titanoxidavfall, farbror2, Att använda som råmaterial inget annat än kväve och luft syre. Denna studie antar att där det finns överskott av kille2, det kommer att finnas oönskade mängder nr3-, som påverkar vattenkraften och kan inkludera alger.
Kan tjäna dig: aldehydosAnsökningar
Köttrying
 Korvarna är ett av de bearbetade kött som innehåller fler nitrater. Källa: Pxhere.
Korvarna är ett av de bearbetade kött som innehåller fler nitrater. Källa: Pxhere. Nitrater läggs till flera kött, särskilt korv, för att eliminera bakterier och därmed försena deras försämring. De reagerar också med sina proteiner för att ge dem en mer rödaktig färg. Problemet med dessa kött är att genom att laga dem vid höga temperaturer producerar de nitrosoaminer: föreningar kopplade till koloncancer.
Denna reaktion undviks delvis om det finns vitaminer, som är fallet med grönsaker, som även om de är rika på nitrater, inte är förknippade med cancerframkallande patologier.
Lantbruk
Nitrater är en löslig kvävekälla. Därför fungerar det som gödningsmedel för att bidra med kväve till växter, och därmed gynna deras tillväxt.
Medicin
Nitrater har en speciell funktion i kroppen. När den assimileras med enzymatisk verkan reduceras den till kväveoxid, nej. Denna molekyl upptar volymen och utvidgar vener och artärer, vilket gör att det kan bli större blodflöde. Därför används nitrater som mediciner för att bekämpa cirkulationssystempatologier.
Ironiskt och nyfiken, för detta ändamål har organiska nitrater såsom glycerilo, nitroglycerin, isosorbid mononitrat och pentaeritritol tetranitrat använts, alla bra kandidater i explosivvärlden.
Explosiva varor
Nitrater används i explosiva formuleringar, varvid krutt är det mest symboliska exemplet. Som oxiderande medel föredrar de förbränning av materia, förutom att bidra till den plötsliga utvidgningen av volymen på grund av att de frigörs efter att de släpps ut efter att sönderdelas.
Exempel på nitrater
Under de tidigare avsnitten har mer än ett exempel på nitrater nämnts. Slutligen kommer vissa andra att listas tillsammans med sina respektive formler och namn:
-Linné3: Litiumnitrat
-Rbno3: Rubidio -nitrat
-Mg (nej3)2: Magnesiumnitrat
-SC (nej3)2: Scandio -nitrat
-Cr (nej3)3: Kromnitrat (iii)
-Zn (nej3)2: zinknitrat
-PB (nej3)2: blynitrat (ii)
-Agno3: silvernitrat
-Ch3Ch2ELLER INTE2: Etylnitrat
-Ch3(Ch2)4ELLER INTE2: Amilo -nitrat
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Clark j. (5 juni 2019). Den termiska stabiliteten hos nitraterna och karbonater. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Wikipedia. (2020). Nitrat. Hämtad från: i.Wikipedia.org
- Angela Dowden. (12 mars 2019). Sanningen om nitraterna i din mat. Hämtad från: BBC.com
- Elsevier b.V. (2020). Nitrat. Vetenskaplig. Hämtad från: Scientedirect.com
- Doktor. Biji S. & Prof. Govindan V. (26 april 2017). Organiska nitrater i den optimala medicinska hanteringen av angina. Europeiska samhället för kardiologi. Återhämtat sig från: escardio.org
- Yuan, s., Chen, J., Lin, z. et al. (2013). Nitratbildning från atmosfärisk kväve och syre fotokatalyserad av nano-SDE-titandioxid. Nat commune 4, 2249. doi.org/10.1038/NCOMMS3249
- « Narrative Therapy Fundamentals of Michael White, Procedure, Techniques
- Epoxy nomenklatur, erhållning, applikationer, exempel »

