Nukleofil nukleofil attack, typer, exempel, nukleofilicitet
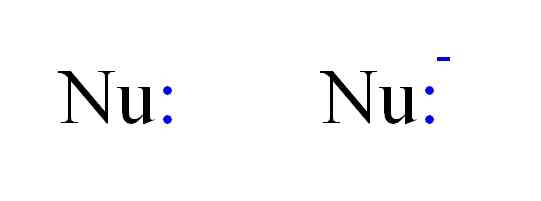
- 807
- 32
- Johan Johansson
En nukleofil Det är allt atom, jon eller molekyl som försöker donera par av elektroner till ämnen med positiva belastningar eller regioner. Ordet betyder "kärlek till kärnorna". När en atom eller en molekylregion är dålig i elektroner upplever den en kraft av större attraktion av atomkärnorna; Och exakt lockar denna attraktion nukleofiler.
Därför måste nukleofiler vara negativa arter. eller åtminstone ha mycket negativa regioner på grund av en lokal eller spridd elektronkoncentration.
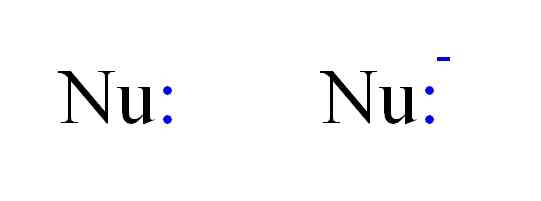 De två vanligaste typerna av nukleofiler i kemi. Källa: Gabriel Bolívar.
De två vanligaste typerna av nukleofiler i kemi. Källa: Gabriel Bolívar. Således kan en nukleofil representeras av Nu -bokstäverna, som i bilden ovan. De dubbla punkterna i blått motsvarar ett par elektroner, som donerar till elektrofilen; Detta är atomen eller den dåliga elektronmolekylen. Observera att nukleofilen kan vara neutral eller anjonisk, men båda donerar elektronpar.
Attacken av nukleofiler till elektrofiler är hörnstenen i otaliga reaktioner och organiska mekanismer. Ett exempel på nukleofil är hydroxylanjon, OH-, som också beter sig som bas. Nukleofilicitet bör emellertid aldrig förväxlas med grunden för ett ämne.
[TOC]
Nukleofil attack
Nukleofiler ser ut. Följande kemisk ekvation representerar nukleofilattacken:
Gnu: + R-LG → R-NU + LG:
Nucleophile Nu: Donerar sitt par elektroner A R, som är kopplad till en elektronegativ LG -grupp. På så sätt är R-LG-länken trasig, LG: s Emigra:, och den nya R-NU-länken bildas. Detta är grunden för många organiska reaktioner.
Det kommer att ses i nästa avsnitt att en nukleofil kan till och med vara en aromatisk ring, vars elektroniska densitet sprids i centrum. På samma sätt kan en nukleofil bli en sigmabindning, vilket innebär att elektronerna i samma emigrerar eller hoppar in i närliggande kärnor.
Kan tjäna dig: kaliumkromat (k2cro4)Typer av nukleofiler
Det finns flera typer av nukleofiler, men de stora större.
Arter med fria elektronpar
När vi pratar om arter med fria elektronpar hänvisar vi till anjoner eller molekyler med elektronegativa atomer, såsom syre, kväve och svavel. I avsnittet Exempel kommer många nukleofiler av denna typ att ses, bortsett från anjon OH- redan nämnt.
Dubbellänkar
En nukleofil kan ha dubbelbindningar, som är ansvariga för den nukleofila attacken. De måste emellertid vara dubbelbindningar med en märkbar elektronisk densitet, så inte någon molekyl som har dem kommer att betraktas som en stark nukleofil; det vill säga det kommer inte att ha en hög nukleofilicitet.
Tänk till exempel på bensenringen i följande reaktion av alkylering (Friedel-hantverksreaktion):
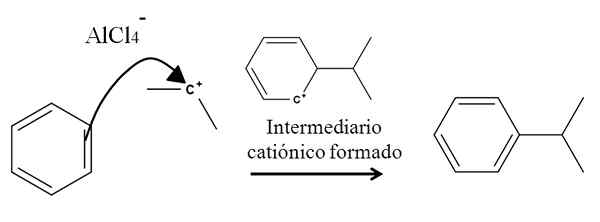 Bensenalkylering i aromatisk elektrofil substitution. Källa: Gabriel Bolívar.
Bensenalkylering i aromatisk elektrofil substitution. Källa: Gabriel Bolívar. Närvaron av en ALCL -blandning3-(Ch3)2CHCL härstammar isopropylkarbokok. Dess positiva belastning och instabilitet lockar starkt elektronerna i en av bensenens dubbelbindningar, som attackerar Carbococation, som representeras av pilen.
Under processen bildas en kort katjonisk och aromatisk mellanliggande, som äntligen förvandlas till rätt produkt.
Förutom med bensen kan andra ämnen med dubbelbindningar fungera som nukleofiler, förutsatt att reaktionsförhållandena är de mest lämpliga. På samma sätt måste det finnas atomer belägna nära dubbelbindningen som donerar elektronisk densitet, så att de "laddar" av elektroner.
Sigmas -länkar
Sigma -bindningar som sådana är inte nukleofiler; Men det kan bete sig som sådan när en reaktion börjar och mekanismen börjar. Tänk på följande exempel:
Det kan tjäna dig: Lindande salter: Vad är, nomenklatur, egenskaper, exempel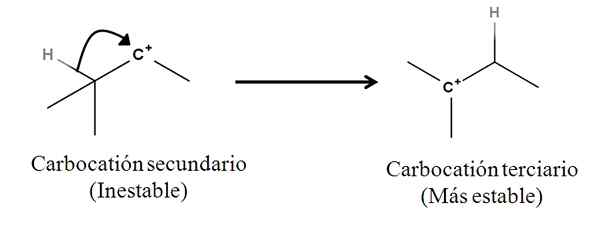 Omvandling av en sekundär till tertiär karbokt genom migration från en hydridanjon. Källa: Gabriel Bolívar.
Omvandling av en sekundär till tertiär karbokt genom migration från en hydridanjon. Källa: Gabriel Bolívar. Sigma C-H-bindningen intill Carbocation rör sig mot honom som beter sig som en nukleofil (se rörelse av den böjda pilen). I detta avseende är resultatet att anjon h rör sig- till det angränsande kolet, men så snabbt att sigmabindningen och dess elektronpar som det nukleofila medlet för denna mekanism övervägs.
Nukleofila exempel
Det här avsnittet kommer att nämna flera exempel på den första typen av nukleofiler, som är mycket rikliga och viktiga i organisk och oorganisk kemi.
Halogenuro
Halogenuros (f-, Kli-, Bras- och jag-) De är nukleofiler. Måste donera ett av sina fyra par valenselektroner. Beroende på hastigheten med vilken en av dessa halogenuros attackerar elektrofi kommer att ha större eller mindre nukleofilicitet.
I allmänhet, i- Det är bättre nukleofil än f- och de andra Halogenuros, eftersom det är lättare att bilda en kovalent länk eftersom den är mer polariserbar; Det vill säga mer skrymmande och med mindre hållbarhet att ge upp sitt par elektroner.
Elektronegativa atombolekyler
 Vattenmolekyler
Vattenmolekyler Vatten, HAH, är en nukleofil, eftersom syreatom har hög negativ densitet och fria elektronpar för att donera och bilda en kovalent bindning. Dessutom är alkoholer, ROH, nukleofiler, av samma skäl som vatten.
Små kvävemolekyler som ammoniak, NH3, De tenderar också att vara nukleofiler. Detta beror på att kväve kan donera sitt ensamma elektronpar. På liknande sätt aminer, RNH2, De är också nukleofiler.
Och utöver små molekyler med syre eller kväve räknas också svavel som nukleofiler. Detta är fallet med vätesulfid, h2S och tioles, rsh.
Svavel är bättre nukleofil än syre och kväve eftersom det är mindre "klamra sig" till dess elektronpar, så det är lättare att donera den. Till detta faktum måste också läggas till att dess atom är mer omfattande, det vill säga mer polariserbar och därför kan bilda kovalenta bindningar med mindre svårigheter.
Det kan tjäna dig: MOHR -metod: Grundläggande, reaktioner, procedur, användningAnjoner
Syresatt, kväve, svaveliserade anjoner, och i allmänhet är flera av dem starka nukleofiler. Detta beror på att de nu har en negativ belastning som ytterligare intensifierar närvaron av paret av elektroner de kommer att donera.
Tänk till exempel på följande anjoner placerade i minskande ordning av nukleofilicitet:
: Ch3- >: NH2- >: Åh- >: F-
Carboanion ch3- Det är den starkaste nukleofilen eftersom kolatomen inte stabiliserar den negativa belastningen, vars elektroner är "desperata" av närliggande kärnor. Detta händer inte med Amiduro, NH2-, vars kväveatom bättre stabiliserar den negativa belastningen och ger lättare paret av elektroner än OH- eller f-.
Nukleofilicitet
Nukleofilicitet definierar hur stark den nukleofila karaktären hos en art är. Detta beror på många faktorer, men det viktigaste är det steriska hinder under den nukleofila attacken och lösningsmedlets verkan.
Ju mindre nukleofilen, desto snabbare och effektiv kommer det att vara din elektrofilattack. Hur mycket lägre interaktioner mellan lösningsmedlet och nukleofilen. Därför, enligt detta, i- har större nukleofilicitet än f-.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- James Ashenhurst. (2020). De tre klasserna av nukleofiler. Återhämtat från: Masterorganicchemistry.com
- Professor Patricia Shaley. (2012). Nukleofiler och elektrofiler. University of Illinois. Återhämtad från: butan.Kem.Uiuc.Edu
- Wikipedia. (2020). Nukleofil. Hämtad från: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 februari 2020). Nukleofil definition i kemi. Återhämtat sig från: tankco.com
- Rachael curtis. (5 juni 2019). Nukleofil. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- « Termodynamiska systemegenskaper, typer, exempel
- Jämliknande berättarekoncept, egenskaper och exempel »

