Kalciumoxalat (CAC2O4) egenskaper, struktur, användningar, risker
- 1658
- 167
- Hans Olsson
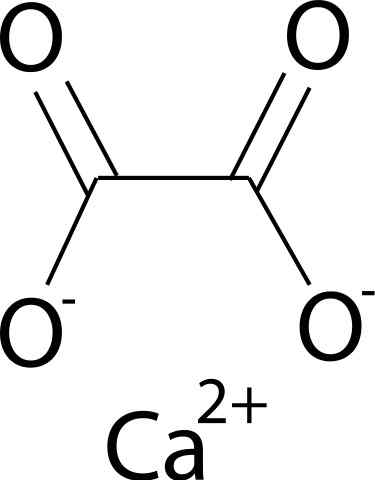
han Kalciumoxalat Det är en organisk förening som bildas av kol (C), syre (O) och kalcium (CA) (CA) (CA). Dess kemiska formel är CAC2ANTINGEN4. Det finns vanligtvis i sina tre hydratiserade former: mono-, di- och trihydrat. Detta är, med en, två eller tre vattenmolekyler respektive i dess kristallina struktur.
Kalciumoxalat finns i mineraler, växter, svampar och andra levande varelser som däggdjur och till och med hos människor till följd av metabolismen hos vissa proteiner. Det finns i urinen hos människor och vissa djur.
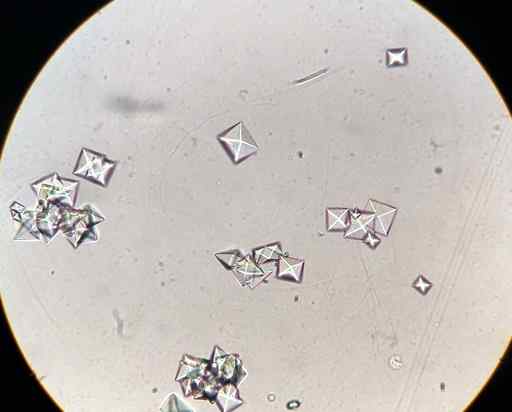 CAC kalciumoxalatkristaller2ANTINGEN4 I ett urinprov observerat med ett mikroskop. J3D3/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
CAC kalciumoxalatkristaller2ANTINGEN4 I ett urinprov observerat med ett mikroskop. J3D3/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Vissa livsmedel som spenat, ruibarbos, soja.
Du kan undvika utseendet på CAC -stenar2ANTINGEN4 I njurarna om många vätskor intas, särskilt vatten, undviker livsmedel med högt oxalatinnehåll och konsumerar de som är rika på kalcium och magnesium.
Kalciumoxalat bildar oönskade inlägg i rör och processtankar som massa och papperstillverkning, och även i ölfabriker.
[TOC]
Strukturera
Kalciumoxalat bildas av kalcium Ca -jon2+ och oxalatjonen c2ANTINGEN42-. Oxalatanjon består av två kolatomer och fyra syreatomer. De negativa massorna av oxalatanjon finns i syreatomer.
 Kemisk struktur av kalciumoxalat. Vsimonian/cc by-sa (https: // creativecommons.Org/licenser/BY-SA/2.5). Källa: Wikimedia Commons.
Kemisk struktur av kalciumoxalat. Vsimonian/cc by-sa (https: // creativecommons.Org/licenser/BY-SA/2.5). Källa: Wikimedia Commons. Nomenklatur
- Kalciumoxalat
- Kalciumsalt i oxalsyran
- Etanodioinsyran kalciumsalt
Egenskaper
Fysiskt tillstånd
Färglös kristallin, vit, gul eller brun som kan vara i tre olika hydratiserade former.
Molekylvikt
128,1 g/mol
Smältpunkt
Kalciumoxalatmonohydrat sönderdelas till 200 ° C.
Spännande vikt
CAC -monohydrat2ANTINGEN4 •H2O = 2,22 g/cm3
CAC dihydrat2ANTINGEN4 •2h2O = 1,94 g/cm3
CAC Trihydrate2ANTINGEN4 •3 timmar2O = 1,87 g/cm3
Löslighet
Nästan olöslig i vatten: 0,00061 g/100 g vatten vid 20 ° C. Monohydrat upplöses i utspädd syra.
pH
Vattenhaltiga kalciumoxalatlösningar är svagt grundläggande.
Kemiska egenskaper
Kalciumoxalat är kalciumsaltet av oxalsyra. Detta är en naturlig sekundär produkt av metabolism, så den är mycket rik i människokroppen och är en del av många livsmedel.
Oxalsyra och dess konjugerade bas, oxalat, är mycket oxiderade organiska föreningar, med en kraftfull kelataktivitet, det vill säga de kan enkelt kombineras med positiva joner med +2 eller +3 belastningar.
Kan tjäna dig: metyl- eller metilo -gruppDess vattenhaltiga lösningar är svagt grundläggande eftersom oxalatjonen tenderar att ta protoner h+ vatten, som frigör OH -joner-. Efter att ha tagit två protoner h+ Oxalatjonen blir oxalsyra h2C2ANTINGEN4:
C2ANTINGEN42- + H2O → HC2ANTINGEN4- + Åh-
Hc2ANTINGEN4- + H2O → h2C2ANTINGEN4 + Åh-
Närvaro
I mineraler
Kalciumoxalat är den vanligaste oxalaten och presenteras i form av mineraler som kallas Whewellita, Weddellita och Caoxite.
Whewellita är CAC monohydrat2ANTINGEN4 •H2Eller och är den mest stabila av formerna av denna förening.
 Whewellita mineralrock. Rob Lavinsky, irocks.com-cc-by-sa-3.0/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Whewellita mineralrock. Rob Lavinsky, irocks.com-cc-by-sa-3.0/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Weddellita är CAC Dihydrate2ANTINGEN4 •2h2O och är mindre stabil än monohydrat.
 Weddelite Mineral Crystals. Leon Hupperichs/CC av (https: // Creativecommons.Org/licenser/av/3.0). Källa: Wikimedia Commons.
Weddelite Mineral Crystals. Leon Hupperichs/CC av (https: // Creativecommons.Org/licenser/av/3.0). Källa: Wikimedia Commons. Caxita är kalciumoxalatet trihydrado cac2ANTINGEN4 •3 timmar2ANTINGEN.
I växter och svampar
Kalciumoxalat är förknippat med torr jord och blad, även med patogener, fri, symbios eller växter associerade med växter. I det senare bildas kristaller av utfällningen av kalcium i form av dess oxalat.
CAC -formation2ANTINGEN4 För svampar har det ett viktigt inflytande på de biologiska och geokemiska processerna för jord, eftersom det utgör en kalciumreserv för ekosystemet.
Närvaro i människokroppen och hos däggdjur
Oxalat har sitt ursprung i levern, i de röda eller erytrocytblodkropparna och i mindre mängd i njurarna. Det bildas av metabolismen av aminosyror (såsom fenylalanin och tryptofan) och genom oxidation av glioxal dialdehyd,.
C -vitamin kan också bli oxalat när man utför sin antioxidantfunktion.
Kalciumoxalat finns i stenarna som bildas i njurarna hos människor eller djur med njursjukdom.
De SO -kallade kalciumoxalatberäkningarna eller stenarna bildas av kristallisationen eller aggregeringen av CAC2ANTINGEN4 I övergripande urin med kalcium och oxalat. Detta innebär att urin innehåller både kalcium och oxalat att det inte är möjligt att nämnda förening förblir upplöst, men fälls ut eller passerar till det fasta tillståndet i form av kristaller.
I människor
Bildningen av sand eller stenar i njurarna är en sjukdom som kallas nefrolithiasis; Den attackerar cirka 10% av befolkningen och cirka 75% av dessa stenar består av kalciumoxalat CAC2ANTINGEN4.
 Kalciumoxalat kan bilda stenar i njurarna. Författare: vsrao. Källa: Pixabay.
Kalciumoxalat kan bilda stenar i njurarna. Författare: vsrao. Källa: Pixabay. Bildningen och tillväxten av kalciumoxalatkristaller i njurarna förekommer eftersom urinen hos vissa människor övermättas med nämnda salt. Kalciumoxalat utvecklas i syra urin i pH mindre än 6,0.
Kan tjäna dig: isóbarosSupeatation uppstår när utsöndring eller eliminering av detta salt (som är mycket lite lösligt i vatten) genom urinen uppstår i en liten volym vatten.
Faktorer som påverkar njurstenens utseende
Bland de faktorer som gynnar bildningen av kalciumoxalat sandiga är överskott av kalcium i urin eller hyperkalciuri, överskott av oxalat i urin eller hyperoxaluri, element härrörande från utfodring och frånvaro av hämmare.
Överskott av oxalat kan uppstå när höga mängder spenat, grov, soja, nötter och choklad intas, bland andra livsmedel.
 Choklad kan vara en källa till kalciumoxalat och gynna utseendet på stenar i njurarna. Författare: Alexander Stein. Källa: Pixabay.
Choklad kan vara en källa till kalciumoxalat och gynna utseendet på stenar i njurarna. Författare: Alexander Stein. Källa: Pixabay. Det finns emellertid ämnen som hämmar eller förhindrar att stenbildning bildas. Bland föreningarna som undviker beräkningar är små molekyler såsom citrat och pyrofosfat och stora molekyler såsom glykoproteiner och proteoglykaner.
Sätt att undvika bildandet av kalciumoxalatstenar
En bra strategi för att förhindra återfall eller kalciumoxalatberäkningar inklusive ökning av flytande intag, ökning av kalciumrika livsmedel (såsom mejeriprodukter) och begränsa bordsalt (NaCl), animaliskt protein, djurprotein och rika måltider i oxalat.
I djur
Sedan början av året 2000. Det verkar som om detta beror på vilken typ av mat som dessa djur intar och har att göra med surhet och magnesiumbrist (MG).
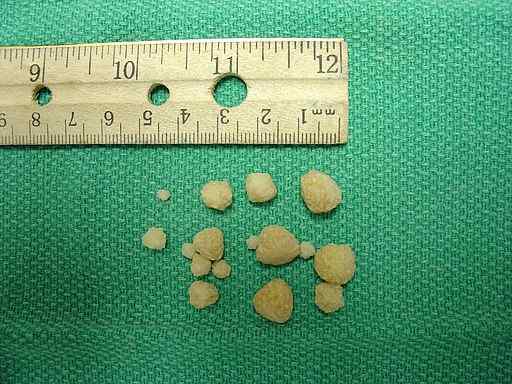 Kalciumoxalatstenar som finns i urinblåsan i en hund. Joel Mills/CC BY-SA (http: // Creativecommons.Org/licenser/BY-SA/3.0/). Källa: Wikimedia Commons.
Kalciumoxalatstenar som finns i urinblåsan i en hund. Joel Mills/CC BY-SA (http: // Creativecommons.Org/licenser/BY-SA/3.0/). Källa: Wikimedia Commons. Kroppssvar på överskott av oxalat
Det finns bevis för att både människor och djur svarar på överskott av oxalat genom att öka antalet bakterier som kan försämra oxalat.
Några av dessa bakterier är Oxalobacterformigen, Bifidobacterium sp., Porphyromonas gingivalis och Bacillus sp., bland andra och finns naturligt i tarmen.
Ansökningar
Enligt konsulterade källor används kalciumoxalat vid keramisk beläggning.
Det har använts för att täcka skulpturer och andra konstnärliga element i kalksten, och det har visat sig att det förbättrar materialets hårdhet, minskar dess porositet och ökar dess motstånd mot syror och alkalis.
 I Italien har det upplevt att täcka föremål kalksten i museer med kalciumoxalat för att bevara dem. Författare: Källa: Moni Quayle. Pixabay.
I Italien har det upplevt att täcka föremål kalksten i museer med kalciumoxalat för att bevara dem. Författare: Källa: Moni Quayle. Pixabay. Problem i vissa processer
I massa- och pappersindustrin kan kalciumoxalat bilda inlagor som orsakar många problem i processen.
För att undvika dess bildning i industriella processkanaler eller rör.
Det kan tjäna dig: koboltklorid (COCL2 (: struktur, nomenklatur, egenskaperDet tenderar också att ackumuleras som sten i behållarna där öl tillverkas, där det måste elimineras för att undvika bildandet av mikroorganismer som kan ge en obehaglig smak att dricka.
Risker
I höga koncentrationer kan oxalat orsaka död hos djur och ibland hos människor på grund av dess frätande effekter.
Ackumulering av oxalat och dess konjugerade syra, oxalsyra, kan orsaka störningar som hjärtfel, kalciumoxalatstenar, njursvikt och till och med död från toxicitet.
Referenser
- Glasauer, s.M. et al. (2013). Metaller och metalloider, transformation av mikroorganismer. Oxalater. I referensmodulering i jordsystem och miljövetenskap. Återhämtat sig från Scientedirect.com.
- Baumann, J. M. och casella, r. (2019). Förebyggande av kalciumnefrolithiasis: Påverkan av diuresis på kalciumoxalatkristallisation i urin. Adv Previum, 2019; 2019: 3234867. NCBI återhämtade sig.Nlm.Nih.Gov.
- BRESHEARS, M.TILL. och konferera, till.W. (2017). Urinsystemet. Kalciumoxalatberäkning. I patologisk grund av veterinärsjukdom (sjätte upplagan). Återhämtat sig från Scientedirect.com.
- Huang och. er al. (2019). TGE -hantering av oxalat i TGE -kropp och TGE -ursprung i Oxalat i kalciumoxalatstationer. UROL INT, 2019 5 dec: 1-10. NCBI återhämtade sig.Nlm.Nih.Gov.
- Nilvebrant, n.-ANTINGEN. et al. (2002). Bioteknik inom massa- och pappersindustrin. Pågår inom bioteknik. Återhämtat sig från Scientedirect.com.
- Pahira, J.J. Och pevzner, m. (2007). Nefrolitiasis. Kalciumsten. I Penn Clinical Manual of Urology. Återhämtat sig från Scientedirect.com.
- Worcester, E. M. (1994). Urin kalciumoxalat kristalltillväxthämmare. J Am Soc Nephrol 1994 nov; 5 (5 Suppl 1): S46-53). Återhämtat sig från Jasn.Asnjournals.org.
- Finkielstein, v.TILL. och Goldfarb, D.S. (2006). Strategier för att förhindra kalciumoxalatstenar. NCBI återhämtade sig.Nlm.Nih.Gov.
- ELLER.S. National Library of Medicine. (2019). Kalciumoxalat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Peck, a.B. et al. (2015). Oxalat-nedbrytande mikroorganismer eller oxalat-nedbrytande enzymer: wich är den framtida terapin för enzymatisk upplösning av kalciumoxalat uroliths vid återkommande stensjukdom? Urolithiasis, 2016 feb; 44 (1): 27-32. NCBI återhämtade sig.Nlm.Nih.Gov.
- Holames, r.P. et al. (2016). Sänker urinoxalatutsöndring för att dekretera kalciumoxalatsten Diepar. Urolithiasis. 2016 februari; 44 (1); 27-32. NCBI återhämtade sig.Nlm.Nih.Gov.
- Cyzar, T.M. (1998). Kalciumoxalat: En ytbehandling för kalksten. Journal of Conservation and Museum Studies 4, sid.6-10. Hämtad från JCMS-Journal.com.
- Wikimedia (2019). Kalciumoxalat. Hämtas från.Wikipedia.org.
- « Kvalitativa forskningsegenskaper, typer, tekniker, exempel
- Funktionalism (psykologi) Ursprung, egenskaper och författare Representanter »

