Oxihemioglobinegenskaper, struktur och korsningskurva
- 2927
- 479
- Erik Eriksson
ANTINGENXihemoglobin Det är namnet som hemoglobin får när det går med syre. Hemoglobin är ett protein som ligger inom de röda blodkropparna och vars huvudfunktion är att transportera syre från lungorna till vävnaderna.
De första levande varelserna var encelliga och bodde i en flytande atmosfär från vilken de var närade och som de eliminerade sitt avfall, liksom några av de organismer som för närvarande finns. Under dessa förhållanden uppnås dessa processer genom enkla spridningsmekanismer, eftersom cellväggen är i intim kontakt med mediet som levererar det.
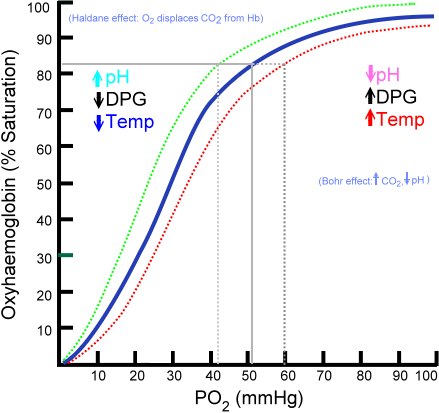
 Dissociationskurva för oxihemioglobin (källa: Ratznium på engelska wikipedialatversioner laddades upp av AaronSharpe vid i.Wikipedia. [Public domain] via Wikimedia Commons)
Dissociationskurva för oxihemioglobin (källa: Ratznium på engelska wikipedialatversioner laddades upp av AaronSharpe vid i.Wikipedia. [Public domain] via Wikimedia Commons) Utvecklingen av alltmer komplexa pluricellulära organismer antydde att inre celler avsevärt flyttades bort från miljön, så spridningsmekanismerna när den enda leveranskällan blev otillräcklig.
Således utvecklades specialiserade system för att få näringsämnen och gaser som matsmältningssystemet och andningsorganen, samt transportmekanismer för att föra dessa näringsämnen och gaser till cellen: det hjärt -kärlsystemet.
För att producera energi i form av ATP -molekyler behöver celler syre. Med tanke på det faktum att ATP inte kan lagras måste den ständigt syntetiseras, vilket innebär en permanent efterfrågan på syre av celler.
Hemoglobin uppstod, evolutionärt talat, som en gastransportör som "löser" problemet med syretransport från miljön till cellen.
[TOC]
Egenskaper och struktur
För att prata om egenskaperna och strukturen hos oxyhemoglobin är det nödvändigt att hänvisa till hemoglobin, eftersom oxyhemoglobin är inget annat än syrehemoglobin. Därför kommer de gemensamma egenskaperna hos molekylen i närvaro eller inte av den aktuella gasen att beskrivas.
Vad är hemoglobin för?
Hemoglobin är nödvändigt för att transportera syre till vävnaderna i den mängd och hastighet som de förtjänar, med tanke på att syre har så lite blodlöslighet att dess diffusionstransport skulle vara otillräcklig för att tillföra vävnadsbehov.
Kan tjäna dig: bevis på utvecklingen av levande varelserHur är en hemoglobinmolekyl?
Hemoglobin är ett tetrameriskt protein (som har fyra underenheter), har en sfärisk form och en molekylmassa på 64 kDa.
Dess fyra underenheter utgör en enda funktionell enhet, där var och en på ett ömsesidigt sätt påverkar den andra. Varje underenhet består av en polypeptidkedja, globin och en protesgrupp, hemo- eller "hem" -gruppen, som fungerar som en kofaktor och inte bildas av aminosyror; det vill säga, det är inte protein natur.
Globin är på två sätt: Alpha Globin och Beta Globin. Hemoglobin -tetrameren består av ett par alfa -globinkedjor (141 aminosyror) och ett par beta globin -kedjor (146 aminosyror).
Var och en av de fyra polypeptidkedjorna är kopplade till en hemo -grupp, som har en järnatom i järnhaltigt tillstånd (Fe2+) i mitten.
Hur är Hemo -gruppen?
Hemo -gruppen är en porfyringring som bildas av fyra pyrroliska ringar (heterocykliska aromatiska föreningar med formeln C4H5N) förenade med metylbroar. Järnet i järnhaltigt tillstånd som finns i mitten är föremål för strukturen genom koordinerade kvävelänkar.
Varje hemo -grupp kan gå med i en syremolekyl, så varje hemoglobinmolekyl kan bara gå med i 4 gasmolekyler.
Människokroppen innehåller cirka 2,5 x 1013 erytrocyter, som är blodcellerna som producerar och transporterar hemoglobin. Varje erytrocyt har cirka 280 miljoner hemoglobinmolekyler och kan sedan transportera mer än 1000 miljoner syremolekyler.
Kan tjäna dig: Hominiseringsprocess: Egenskaper och faserHur bildas oxyhemoglobin?
Oxihemioglobin bildas efter föreningen av en syreatom till varje järnat järnatom som hittar i varje hemo -grupp av hemoglobinmolekylen.
Termen oxihemioglobin hänvisar sedan till ett syresatt och inte kemiskt oxiderat hemoglobin, eftersom det inte förlorar en elektron när den kombineras med syre och järn kvarstår i järnhaltigt tillstånd.
Syregenering ger en förändring i den kvartära strukturen i molekylen, det vill säga en förändring i konformation som kan överföras från Globin -kedjorna till hemo- och vice versa -gruppen.
Vad är den maximala mängden syre som kan ladda hemoglobin?
Hemoglobin kan högst ansluta sig till fyra syremolekyler i dess struktur. Om den molära volymen av idealiska gaser är 22.4 L/mol, en mol hemoglobin (64.500 g) kommer att gå med 89.6 liter syre (4 mol O2 x 22.4 l/mol).
Så varje gram hemoglobin måste gå med 1.39 ml O2 för att vara 100% mättad (89.6l/64500g x (1000 ml/l)).
I praktiken visar blodprover något lägre resultat, eftersom det finns små mängder metemoglobin (oxiderat hemoglobin) och karboxihemoglobin (hemoglobin + kolmonoxid (CO)) som inte kan förena syre.
Med hänsyn till detta fastställer "Hüfner" -regeln att i blodet har 1 g hemoglobin en maximal kapacitet att förena syre på 1.34 ml.
Oxyhemoglobinbindningskurva
Mängden syremolekyler som kan förenas till en hemoglobinmolekyl beror på det partiella syretrycket eller PO2. I frånvaro av syre avlägsnas hemoglobin, men när PO2 ökar ökar antalet syre som binder till hemoglobin.
Syrebindningsprocessen till hemoglobin beroende på partiellt syretryck. Vid grafering kallas resultatet "oxihemioglobin curve" och har en karakteristisk form av 's' eller sigmoid.
Kan tjäna dig: TaxismBeroende på PO2 kommer hemoglobin att ha en mindre eller större kapacitet att "frigöra" eller "leverera" syre som den transporterar, samt laddas med detta.
Till exempel i regionen mellan 10 och 60 mmHg tryck får du delen med mer väntande kurvan. I detta tillstånd kan hemoglobin enkelt ge stora mängder O2. Detta är tillståndet som uppnås i vävnaderna.
När PO2 är mellan 90 och 100 mmHg (12 till 13 kPa) är hemoglobin nästan 100% mättat med O2; Och när arteriell PO2 är 60 mmHg (8 kPa) är mättnaden med O2 fortfarande så hög som 90%.
I lungorna är dessa förhållanden som dominerar (tryck mellan 60 och 100 mmHg), och detta är som tillåter hemoglobinmolekyler som finns i erytrocyter att laddas med syre.
Denna sigmoidform som drar oxihemioglobinkurvan säkerställer att detta protein uppträder som en utmärkt laddare på lungnivån, en mycket effektiv transportör i blodtrycket och en utmärkt O2 -donator i vävnaderna, i proportion till den lokala metaboliska hastigheten, det vill säga, det vill säga, det vill säga att kräva.
Referenser
- Räv, s. Yo. (2006). Mänsklig fysiologi 9: e upplagan (PP. 501-502). McGraw-Hill Press, New York, USA.
- Murray, r. K., Granner, D. K., Mayes, s. TILL., & Rodwell, V. W. (2014). Harpers illustrerade biokemi. McGraw-hill.
- Rawn, j. D. (1998). Biochemistry (1989). Burlington, North Carolina: Neil Patterson Publishers (c) n. Lalioti, CP Raptopoulou, A. Terzis, a. Panagiotopoulos, SP Perlepes och. Manessi-Zouopa, J. Kem. Soc. Dalton Trans, 1327.
- Robert M. Berne, Matthew n. Avgift. (2001) Fysiologi. (3: e upplagan.) Harcourt Editions, s.TILL.
- West, J. B. (1991). Fysiologisk grund för medicinsk praxis. Williams & Wilkins
- « Erytropoietin (EPO) egenskaper, produktion, funktioner
- Dystrofinegenskaper, struktur och funktioner »

