Pepsinogen struktur, funktioner, typer, syntes
- 1148
- 221
- Per Eriksson
han Pepsinogen Det är zimogenen i pepsin, en av de viktigaste hydrolytiska enzymerna som ansvarar för att utföra proteinmatsmältning i däggdjursmagen. Zimogener eller proenzymer är inaktiva enzymatiska föregångare, det vill säga de kan inte katalysera de reaktioner som utförs av deras aktiva former.
Dess aktivering beror på förändringar i den tre dimensionella strukturen hos proteinet som ger upphov till bildandet av ett funktionellt aktivt ställe. Dessa förändringar sammanfaller i de flesta fall med det proteolytiska brottet i ett proteinsegment.
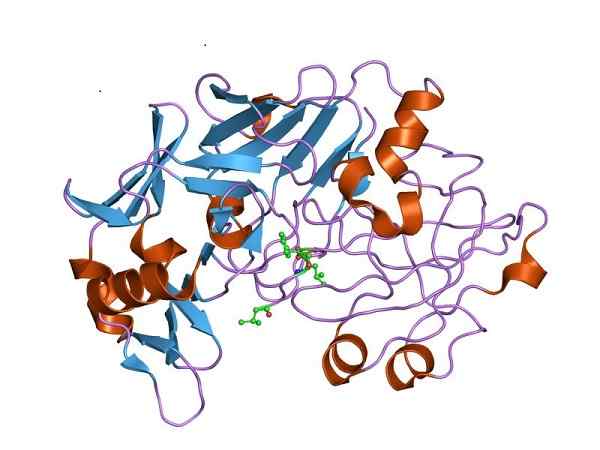
 Tre -dimensionell struktur av pepsin, den katalytiskt aktiva formen av pepsinogen. Av Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain (https: // CreativeCommons.Org/licenser/BY-SA/4.0)], från Wikimedia Commons
Tre -dimensionell struktur av pepsin, den katalytiskt aktiva formen av pepsinogen. Av Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain (https: // CreativeCommons.Org/licenser/BY-SA/4.0)], från Wikimedia Commons Därför måste pepsinogen uppleva strukturella förändringar för att skaffa den nödvändiga peptidasaktiviteten och gynna proteinsatsmältning i magen efter matintag.
[TOC]
Strukturera
Pepsinogen är ett 371 aminosyratprotein som tillhör den stora familjen av aspartiska proteinaser, kännetecknad av att presentera aspartinsyrarester i dess aktiva centrum.
Dess kvartära struktur bestämdes för första gången för proteinet uttryckt i grisar genom X -Ray -kristallografitekniken. Resultatet liknade det som uppvisades av den mogna eller aktiva formen av proteinet, pepsin.
Således är den enda skillnaden som hittades närvaron i pepsinogen av en 44 aminosyraspeptid som fälls över klyftan på det aktiva stället. I denna position hindrar det interaktionen mellan detta proteas med proteiner som ska försämras.
Denna peptid som kommer att klädas för att ge upphov till det aktiva enzymet är beläget vid proteinets aminoterminal.
Eftersom det endast fungerar som ett mössa beror oförmågan hos det nedbrytande proteinet Pepsinogen inte på strukturella deformationer av det aktiva centrumet. Tvärtom, detta kvarstår med samma konformation i båda formerna av enzymet.
Kan tjäna dig: glukaner: struktur, egenskaper och funktionerI detta avseende är det värt att notera att kristallstrukturen i pepsinogen utgör en ungefärlig modell av strukturen hos andra zimogenos som tillhör den stora familjen av aspartiska proteiner.
Funktioner
I början av livet är pepsin (aktiv form av pepsinogen) viktigt för mjölkmatsmältningen. Därefter är dess funktion att försämra dietproteiner i deras beståndsdelar (aminosyror) för att underlätta deras enkla absorption.
Syntes och utsöndring
Pepsinogen syntetiseras av huvudcellerna och den fundiska cellerna i magslemhinnan. Därefter lagras det i sekretoriska vesiklar som finns kvar i cytoplasma i dessa celler fram till det ögonblick som deras frisläppande krävs.
Därför är utsöndringen av denna zimogen en process som regleras. Dess frisläppande av vesiklar, invånare i cytosol genom exocytos, kräver hormonella och neurala stimuli. Ökningen i nivåerna av gastriska enzymer utsöndrar och gastin, såväl som acetylkolin, kolecystokinin, epidermal tillväxtfaktor och kväveoxid stimulerar deras syntes och utsöndring.
Dessutom har experiment genomförda med ATT20 -celler, en cellinje som vanligtvis används i studien av utsöndringsvägar hos däggdjur, visat att en ökning av cyklisk AMP också kan inducera sådan utsöndring.
Förutom sin normala utsöndring på magnivå har en relativt låg mängd pepsinogen upptäckts i både blod och urin, varför den har kallats uropepsinogen.
Uropepsinogens ursprung, liksom den funktion som den kan utföra på båda platserna, förblir utan att bestämmas. Men deras frånvaro hos patienter som helt har tagit bort magen verkar indikera att deras ursprung är lika mage.
Grabbar
Två huvudtyper av pepsinogen har beskrivits hittills: Pepsinogen I och Pepsinogen II. Båda typerna presenterar inte skillnader i sin katalytiska aktivitet och aktiveras lika genom proteolytisk hydrolys beroende på saltsyra.
Kan tjäna dig: Protein denaturation: Vad är, faktorer, konsekvenserPepsinogen I syntetiseras och segregeras av både huvudcellerna och av de fundiska cellerna i magslemhinnan. Därför minskar dess utsöndring hos patienter med atrofisk kronisk gastrit, en magsjukdom som kännetecknas av det totala försvinnandet av gastriska körtlar.
Till skillnad från det senare syntetiseras Pepsinogen II (PGII) av praktiskt taget alla celler som är en del av magslemhinnan, men mer framträdande av de från Antral slemhinnan och de som utgör brünner -körtlarna som finns i duodenum.
Hos patienter med atrofisk kronisk gastrit kompenserar denna typ av pepsinogen för minskning av pepsinogens sekretion i.
Förekomsten av dessa två typer av pepsinogen, som bara skiljer sig genom att utsöndras av olika celler, kan verka överflödiga. Det kan emellertid vara en evolutionär anpassning för att garantera pepsinsyntes när det är nödvändigt.
Aktivering
Pepsinogen förvärvar katalytisk aktivitet när den omvandlas till pepsin, produkt från eliminering av den 44 aminosyran som finns i den aktiva platskaviteten.
Dess optimala drift beror på låga pH -värden som ingår i intervallet 1,5 till 2. Under fysiologiska förhållanden upprätthålls dessa värden av utsöndring av saltsyra i intracellulära kanaler.
Syra matsmältning på magnivå sker inte i alla djur, vilket är ett exempel på detta är insekter, som saknar pepsinogen. Men ryggradsdjur som har mage om de har peptisk aktivitet.
Pepsinogen, som lagras i de sekretoriska vesiklarna i huvudcellerna, släpps till gastrisk kanal vid behov. När den når magen blir den pepsinprodukt från den sura miljön och denna aktiva mer pepsinogena molekyler.
Genom verkan av inneboende nervfibrer och vagal extrinsisk stimulering stimuleras pepsinogenproduktionen, liksom HCl, gastrin och histamin. Å andra sidan stimulerar histamin och gastrin parietalceller att utsöndra HCl.
Kan tjäna dig: ledande tyger: vad är, egenskaper, funktionerPepsin, som allt endopeptidas, verkar på specifika kopplingar mellan proteinaminosyror för att generera mindre peptider.
Med andra ord; Hydrolyserar de inre peptidbindningarna i ett protein. Dess verkan är mer effektiv i peptidlänkar nära aromatiska aminosyror (fenylalanin, tyrosin). Till skillnad från dess föregångare zimogen ger de adaptiva förändringarna av pepsin i pH -värden större än 6 irreversibla minskningar av katalytisk aktivitet.
Referenser
- Bryksa BC, Tanaka T, Yada RY. N-terminal modifiering Öka stabiliteten i neutral-pH. Biokemi. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Jämförelse av de primära strukturerna för sura protessa och deras zymogener. Adv exp med biol. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Lärobok av medicinsk fisiologi. (11: e upplagan.). USA: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, principer för internmedicin. (16: e upplagan.). Mexiko: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Allvarlig atrofisk gastrit med Helicobacter pylori -infektion och gastrisk cancer. Magcancer. 1998; 1: 118-124.
- Lin Y, Found M, Lin X, Hartsuck JA, Tang J. pH-beroende av kinetiska parametrar för pepsin, rhizopuspepsin och deras vätebindningsmutanter på aktiva platser. J Biol Chem. 1992; 267: 18413-18418.
- Mangeeat p. Syrasekretion och membran omorganisation i enstaka gastrisk parietalcell i primärkultur. Biologicell. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Utveckling av gastrisk sekretionsfunktion. Foster och neonatal fysiologi (femte upplagan). Volym 1, sidorna 881-888.
- Schubert ML. Gastrisk hemlighet. Current Opin Gastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James Mng. Molekyl- och kristallstrukturerna hos monoklinisk svinpepsin förfinad vid 1.8 Å Resolution. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Elder JB. Epidemiologin för lågt serum Pepsinogen A -nivåer och en internationell förening med gastrisk cancerhastigheter. Gastroenterologi. 1994; 107: 1335-1344.
- Wolfe MM, Soll AH. Fysiologin för magsyrhemlighet. N engelska J Med 1998; 319: 1707.
- « G -cellerutveckling, gastrin, torvtypo -kanaler
- Nanche -egenskaper, livsmiljöer, egenskaper, matlagningsrecept »

