Väteperoxid (H2O2) struktur, egenskaper, användningar, erhållning

- 4759
- 1183
- Anders Larsson
han Väteperoxid Det är en oorganisk förening vars kemiska formel är h2ANTINGEN2. Alla är den enklaste peroxiden i denna familj av kemiska föreningar. Dess strukturella formel är H-O-O-H, och denna inre syresättning är karakteristisk för alla peroxider.
1818, h2ANTINGEN2 Det identifierades av Louies Jacques Thénard, som förberedde en kemisk förening som han krävde då Huzigenada. Det är en instabil förening, sönderdelas genom exponering för ljus, värme och vissa metaller.
 Kemisk formel av väteperoxid
Kemisk formel av väteperoxid Det är en mycket användbar förening som används vid desinfektion av mindre sår, hårblekning, vattenbehandling etc. Även om han kan ha skadliga handlingar för människan, finns den i alla eukaryota celler av levande varelser, där han utför flera gynnsamma funktioner.
Väteperoxid producerar oxidation av toxiska ämnen såsom fenoler, etanol, formaldehyd, etc., produkter som elimineras av levern och njurarna. Dessutom bidrar det till förstörelsen av bakterierna fagocyterade av neutrofil och makrofag leukocyter.
[TOC]
Strukturera
Molekyl
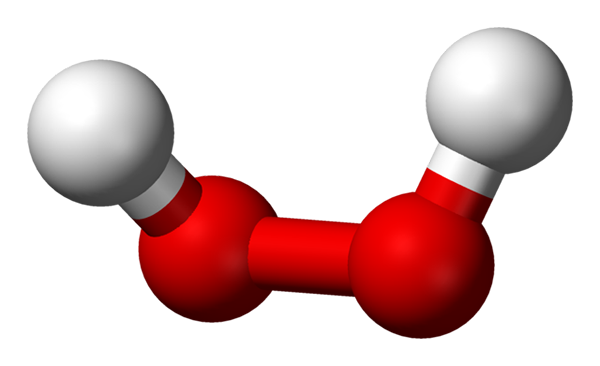 Väteperoxidmolekyl representerad med en sfärer och staplarsmodell. Källa: Benjah-Bmm27 via Wikipedia.
Väteperoxidmolekyl representerad med en sfärer och staplarsmodell. Källa: Benjah-Bmm27 via Wikipedia. I den överlägsna bilden kan strukturen för H -molekylen ses2ANTINGEN2 (H-O-O-H), med de röda sfärerna som motsvarar syreatomer och vita väteatomer. Observera att molekylen inte är platt och att varken atomerna h är förmörkade i rymden (en framför den andra).
Intressant, till h2ANTINGEN2 Det är svårt att rotera sin enkla centrala länk O-O, så positionerna för dessa H kan inte utbytas; Den ena kommer inte att gå ner medan den andra går upp.
Därför att? För i de två syreatomerna finns det två elektronfria par, som ger totalt åtta mycket nära elektroner och som avvisar varandra för deras negativa laddningar.
Rotationer
Trots det kommer O-O-länken sannolikt att rotera på grund av interaktioner med dess omgivningar.
Till exempel, när de två tummen tillsammans med fingrarna är utsträckta och de andra stängda, till exempel att rita en domstol och sedan vända tummen på ett sådant sätt att en av fingrarna riktar sig framåt och den andra bakåt, kommer det att finnas en ungefärlig representation av h2ANTINGEN2.
Om en kropp spelar något av indexen kommer tummen att rotera som svar på denna interaktion; Men de kommer omedelbart att återgå till sin ursprungliga position på grund av de elektroniska avstötningarna som nämns ovan. Dessa rotationer ramar in de dynamiska aspekterna av denna molekyl.
Intermolekylär interaktioner
I vätsketillståndet h2ANTINGEN2 lyckas etablera vätebroar (Hooh-O2H2), annars skulle dess höga kokpunkt (150 ºC) inte förklaras jämfört med vattnet.
Kan tjäna dig: kalciumsulfat (case4): kemisk struktur, egenskaper, användningarNär den går till gasfasen, M -molekylerna2ANTINGEN2 Förmodligen kan inte längre bilda sådana broar, inte bara till det största intermolekylära avståndet, utan också väteatomerna skulle vara de första som berörs vid kollisioner (detta kan visualiseras genom att ta tillbaka till fingrarmodellen).
Under tiden, i fast fas är vinkeln på planen som fastställer H är 90º (sätter de vinkelräta fingrarna) fingrarna). Nu blir vätebroar ännu viktigare och H -molekyler2ANTINGEN2 De beställs i en tetragonal strukturkristall.
Egenskaper
Sbotella med väteperoxid. På apotek uppnås det med en koncentration av 3% m/v. Källa: Pixnio.
Namn
-Väteperoxid
-Dioxidano
-Oxidanol
-Perhydoxinsyra
-O-hydroxyol
-Väteperoxid
Molmassa
34,0147 g/mol
Fysiskt utseende
Blekblå (koncentrerad) eller färglös. Det är något mer visköst och tätt än vatten. Det destilleras för säkerhet vid låga temperaturer och minskat tryck, eftersom det sönderdelas genom explosivt uppvärmning.
Lukt
Akut eller en lukt som liknar ozon.
Smak
Bitter
Densitet
Solid 1,71 g/cm3
Densiteterna för deras vattenhaltiga lösningar beror på deras koncentration; Till exempel har 27 % en densitet på 1,10 g/cm3, medan 50 %, 1,13 g/cm3
Smältpunkt
- 0,43 ºC
Kokpunkt
150,2 ºC. Detta värde har erhållits genom extrapolering, eftersom väteperoxid sönderdelas vid höga temperaturer.
Vattenlöslighet
Belopp ≥ 100 mg/ml vid 25 ° C
Löslighet
Det är lösligt i eter och alkohol, men olöslig i oljeeter. Det sönderdelas i vatten och syre i många organiska lösningsmedel.
Oktanol/vattenpartitionskoefficient
Log P = - 0,43
Ångtryck
5 mmHg vid 30 ºC.
Dissociationskonstant
PKA = 11,72
pH
Väteperoxidlösningar är något sura. Till exempel har en till 35% ett pH på 4,6; Men när man koncentrerar sig till 90%blir pH mindre sur: 5.1.
Brytningsindex (nD)
1 4061
Gegga
1,245 CPOISE vid 20 ° C.
Värmekapacitet
1 267 J/G · K (gas)
2,619 J/g · k (vätska)
Förångningsvärme
1,519 j/g · k
Stabilitet
Stabil under de rekommenderade förhållandena. Tillsatsen av acetanylid- och tennsalter stabiliserar den mer.
Korrosion
Frätande
Sönderfall
Det sönderdelas genom exponering för ljus eller i närvaro av oxidation och reducerande ämnen. Det är också uppdelat genom uppvärmning. När det beslagtas släpps vatten och syre och gynnas av en ökning av pH och temperatur, liksom med närvaron av katlasieenzymet.
Kan tjäna dig: natriumperoxid (Na2O2): struktur, egenskaper, användningarYtspänning
80.4 DINS/CM A 20 ºC
Reaktivitet
H2ANTINGEN2 Det fungerar som ett oxiderande medel i syralösningar av järnhalt (tro2+) Järnjärn (f3+); oxidera också sulfitjon (så32-) till sulfatjon (så42-).
Det kan också fungera som ett reducerande medel i närvaro av grundläggande lösningar, vilket reducerar till natriumhypoklorit (NaOCL) och kaliumpermanganat (KMNO4) Med syrefrisättning.
Ansökningar
Blekning
Väteperoxid används i pappersindustrin i blekning av massa och papper, som förbrukar det mesta av sin årliga produktion.
Desinfektionsmedel
Väteperoxid är ett mildt antiseptiskt medel för att undvika liten sårinfektion, skrot och brännskador. Det används också som munnsköljning och för att lindra mild munirritation på grund av närvaron av munstycken eller tandköttsinflammation.
Det används också för att desinficera ytor, inre kylskåp, vatten och bekämpa överdriven bakterietillväxt i vattensystem och kyltorn. Väteperoxid frigör syrefria radikaler, som sönderdelas föroreningar.
Rengöringsmedel
Väteperoxid används vid tillverkning av blekningsmedel i kläderna, inklusive natriumkarbonat. Denna förening är ett komplex av natriumkarbonat och väteperoxid som löses i vattnet separerar i dess komponenter.
Kosmetisk applikation
Utspädd väteperoxid används i hårblekning, före färgning. Det används också för att bleka tänderna, som en del av en hemlagad tandkräm.
Drivmedel
Väteperoxid används som monoporpellant eller oxiderande komponent i en bipropoonous raket. Det bryter ned och släpper syre och vatten, en egenskap som tillät dess användning som drivmedel.
En reaktionscell pumpas med närvaron av en katalysator som accelererar sade nedbrytning. Under detta produceras vattenånga vid hög temperatur.
När ånga utvisas genom ett gap producerar en impuls. V-80-ubåten som byggdes 1940, som användes i syreturbinerna genererade från väteperoxid; kallas Walter Turbine System.
Erhållande
Ursprungligen erhölls väteperoxid industriellt genom hydrolys av ammoniumpersulfat, [(NH4)2S2ANTINGEN8] eller elektrolysen av ammoniumbisulfat, NH4Hso4.
Väteperoxid erhålls industriellt genom användning av antakinon. Processen utförs i fyra steg: hydrering, filtrering, oxidation, extraktion och rening.
Kan tjäna dig: magnesiumfluorid: struktur, egenskaper, syntes, användningHydrering
Alquilantroquinona hydreras genom att passera vätgas genom en hydratator laddad med aluminiumoxid och en liten mängd katalysator (paladium). Temperaturen upprätthålls vid 45 ° C med permanent omröring.
Alkyndrokinon omvandlas till alquiloantrahydroquinona och tetrahydroalquilantrahydroquinonen och väljer den senare för dess största bekvämlighet för följande procedurer.
Filtrering
Lösningen innehöll.
Oxidation
Den filtrerade lösningen oxiderar genom att passera luft genom den och bilda väteperoxid med låg renhet.
Extraktion och rening
Lösningen med väteperoxid korsar en vätskevätskekstraktionskolonn. Vatten rinner genom kolonnen, medan lösningen med väteperoxid pumpas av den.
Vattnet når botten av extraktorn med en koncentration av väteperoxid mellan 25 och 35 % p/p. Sedan renas den genom vakuumdestillation, till en 30 % väteperoxidkoncentration. Slutligen stabiliserad och lagrad.
Risker
 Väteperoxidförbränning. Källa: Bobjgalindo [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Väteperoxidförbränning. Källa: Bobjgalindo [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Väteperoxid är ett frätande medel, så hudkontakten producerar allvarlig irritation, utöver tillfällig blekning (överlägsen bild). Det kan också ge ögonskador, klåda, salpt, rodnad och ampoulesbildning.
Dess inandning ger irritation i näsan, halsen och lungorna. Samtidigt kan upprepad exponering orsaka bronkit, hosta, slem och andningskortning. Och som om det inte räckte, genererar det också huvudvärk, vahid, illamående och kräkningar.
Allvarlig exponering för väteperoxid kan producera vätskansamling i lungorna, som kallas ett lungödem: allvarligt tillstånd som kräver snabb läkarvård.
Arbetssäkerhets- och hälsoadministrationen (OSHA) har etablerat det maximala tillåtet för väteperoxid på 1 ppm i en arbetsmiljö på en 8 -timmars dag. Men eftersom det är en mutagen förening måste exponering för det minsta minskas.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Väteperoxid. Hämtad från: i.Wikipedia.org
- William R. Bussning och Henri a. Avgift. (2004). Kristall och molekylstruktur av väteperoxid: en neutron - diffraktionsstudie. doi.org/10.1063/1.1696379
- Nationellt centrum för bioteknikinformation. (2019). Väteperoxid. Pubchemdatabas. CID = 784. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Redaktörerna för Enyclopaedia Britannica. (27 november 2018). Väteperoxid. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- New Jersey Department of Health. (2016). Väteperoxid. [Pdf]. Återhämtat sig från: nj.Gov
- Mathews, C. K., Van Holde, K. OCH., Ahern, K. G. (2002). Biokemi. Tredje upplagan. Pearson Addison Wesley redaktion
- MD -webb. (2019). Väteperoxid. Hämtad från: WebMD.com
- « Aztec medicinhistoria, Gud, växter, sjukdomar
- Zinkoxid (ZnO) struktur, egenskaper, användningar, risker »

