Peroxides egenskaper, nomenklatur, användning, exempel
- 671
- 130
- Prof. Erik Johansson
De peroxider De är alla de kemiska föreningar som innehåller peroxo-gruppen, O-O, antingen kovalent kopplade till kolatomer eller andra funktionella grupper, eller i jonform såsom peroxidanjonen, eller22-. Ovanstående representeras grafiskt i bilden nedan. I den sticker O-O-gruppen med en blå färg.
Det kan finnas organiska peroxider såsom diaquilperoxider (R1-O-o-r2), Hydroperoxider (R-O-O-H), peracider (RCO-O-O-H) och PeéStres (R1Co-o-r2). Vi har också oorganiska peroxider, såsom metallperoxider (Mn+ANTINGEN22-) och väteperoxid (H-O-H). Det senare är den mest kända av alla och får namnet väteperoxid.
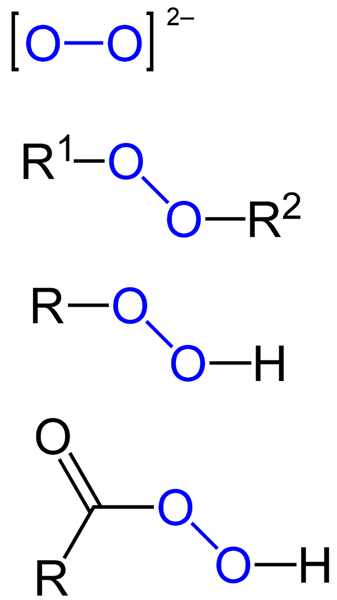 Formler för olika typer av peroxider som finns. Källa: Jü / Public Domain
Formler för olika typer av peroxider som finns. Källa: Jü / Public Domain Alla peroxider delar gemensamt egenskapen att vara mycket reaktiva, oxiderande ämnen och i vissa fall explosiva. Såvida de inte specificeras genom att syntetisera dem, betraktas de som oönskade och farliga föroreningar för många industriella processer och för laboratoriesyntes.
Peroxider i allmänhet är utmärkta oxiderande medel, blekning, bakteriedödar och polymerisationer aktivatorer via bildning av fri radikal. Det är därför de vanligtvis är mycket användbara reagens eller tillsatser inom polymerindustrin, liksom inom livsmedelsindustrin för att påskynda oxidationer och eliminera bakterier.
[TOC]
Peroxidegenskaper
Strukturera
Peroxidstrukturer fokuserar runt O-O-gruppen. Varje syreatom har en SP -hybridisering3, Så länkarna -inte vila i samma plan. Till exempel för väteperoxid, H-O-H, är vinkeln som bildas mellan de två H 115 115.5: e, som visar att de fyra atomerna inte är på ett plan.
Förvrängningarna av detta och andra vinklar beror på identiteten hos de andra molekylfragmenten kopplade till O-O-gruppen.
Det kan tjäna dig: Gibbs Free Energy: Enheter, hur det beräknas, lösta övningarÅ andra sidan kan organiska och oorganiska peroxider (utom metalliska) erkännas med blotta ögat om O-O-gruppen är detaljerad i deras struktur, till exempel två glas med en "mun". På detta sätt identifieras varje peroxid omedelbart med en enda vy av dess struktur.
Reaktivitet
O-O-länken är relativt svag jämfört med andra länkar som C-H eller C-O. Det är därför det tenderar att bryta eller fragment för att producera mycket reaktiva syresatta radikaler.
De beror på dessa radikaler som peroxider klassificeras som reaktiva och farliga ämnen, eftersom de kan skada vävnader och eventuella organiska ämnen i allmänhet.
Oxiderande handling
Peroxider är kraftfulla oxiderande medel och försöker få elektroner från miljön för att förvandlas till vatten, syre eller hydroxider. Till exempel är väteperoxid ett starkare oxidantmedel än samma kaliumpermanganat.
Denna oxiderande verkan används för att upptäcka dem genom deras reaktion med järnhaltig sulfat och kaliumtiocyanat:
Peroxid +tro2+ + SCN- → Fe (SCN)n(3-n)- (N = 1 till 6).
Komplexet bildas mellan tro3+ och SCN- Det är blodrött, så observationen av denna färg motsvarar ett positivt test för närvaron av peroxider i provet.
Känslighet
Peroxider är ämnen som är känsliga för höga temperaturer och solljus. Därför måste de förvaras på säkra platser och inom plast- och ogenomskinliga behållare, så att ljus inte påverkar dem direkt direkt.
Nomenklatur
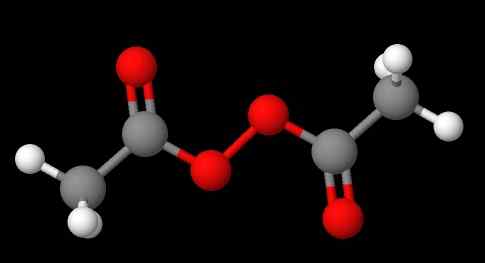
Peroxidernas nomenklatur beror på vilken typ de hör hemma. I allmänhet utses många genom att nämna "peroxid av" följt av substituenterna r i alfabetisk ordning. Till exempel sammansatt ch3C (o) ooc (o) ch3 (lägre bild) kallas diacetyl- eller acetylperoxid, eftersom den har en acetylgrupp i varje ände.
Kan tjäna dig: natriumsulfat (Na2SO4): Struktur, egenskaper, användningar, erhållning Diacetylperoxid. Källa: Gabriel Bolívar via Molview.
Diacetylperoxid. Källa: Gabriel Bolívar via Molview. Föreningen C6H5C (O) OOC (O) C6H5 (lägre bild), å andra sidan, kallas den Dibenzoílo eller Benzoílo peroxid, av samma skäl som anges i föregående stycke.
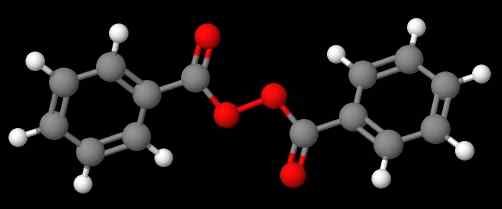 Bensoylperoxid. Källa: Gabriel Bolívar via Molview.
Bensoylperoxid. Källa: Gabriel Bolívar via Molview. Under tiden sammansatt C6H5C (o) ooc (o) ch3 kallas acetylbenzolelo peroxid. Den här gången nämns acetylsubstituenten först för att ha börjat med bokstaven 'A'. Ett annat exempel är ch3Ch2Ooc6H5, kallas etylfenylperoxid.
På samma sätt fortsätt med hydroperoxider. Till exempel Cho3OOH kallas metylhydroperoxid.
Träning
Vissa peroxider kan bildas direkt genom exponeringen av ämnet i fråga med syre i luften, assisterad eller inte med metallkatalysatorer. De kan också bildas genom att exponera ämnet för ozon under vissa förhållanden och genomföra ozonolysreaktionen.
En annan syntetisk väg är att reagera väteperoxid med en alkylorsulfat:
R2Sw4 + H2ANTINGEN2 → R-O-R +H2Sw4
För att syntetisera eller bilda diachiliska peroxider eller till och med cykliska peroxider.
Samtidigt baseras flera av metoderna för att bilda metallperoxider på att syrat sina respektive metalloxider, så att de "syre" och går från att vara mo (mn+ANTINGEN2-) kärlek2 (Mn+ANTINGEN22-).
Peroxider använder
Polymerisationer initiativtagare
Peroxider, särskilt organiska peroxider, tillsätts reaktionsmedel för syntes av oändligheter av plast och material såsom polystyren, silikon, epoxi och akrylhartser, polyvinylklorid, glasfiber, mellan andra.
Detta beror på att de lider av termiska sönderdelningar för att bli syresatta fria radikaler, som i sin tur utlöser och katalyserar polymerisationer. Därför är de önskvärda inom polymerindustrin.
Det kan tjäna dig: Molarfraktion: Hur det beräknas, exempel, övningarNågra av de peroxider som används som initiativtagare är metylcetona (MEK) peroxid och acetonperoxid.
Blekmedel och desinfektionsmedel
Peroxider är blekmedel som används för blekning av papper och mjölmassa. De är också desinfektionsmedel, helt effektiva men aggressiva när det gäller utrotning av bakterier. Det klassiska exemplet motsvarar väteperoxid, avsedd i utspädda lösningar (3%) för att desinficera sår.
Oxiderande medel
Peroxider är också oxiderande medel, så de finner många användningsområden i organisk syntes av mycket syresatta ämnen.
Syrekällor
Även om det inte är bland dess huvudanvändning, kan peroxider också fungera som källor till syre i några av deras nedbrytningar. Detta är fallet återigen av väteperoxiden.
Exempel på peroxider
Slutligen kommer några exempel på peroxider att listas, vare sig det är organiskt eller oorganiskt, med sina formler och respektive namn:
-H2ANTINGEN2: Väte- eller väteperoxid
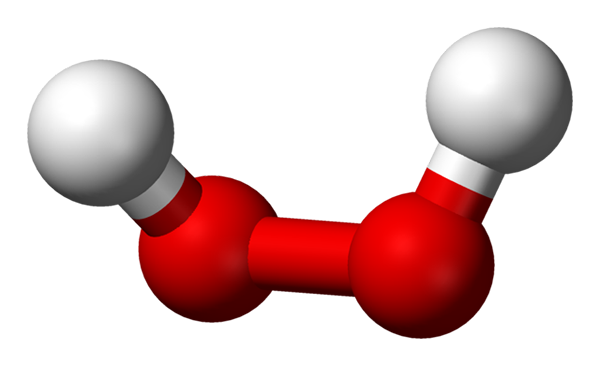 Väteperoxidmolekyl representerad med en sfärer och staplarsmodell. Källa: Benjah-Bmm27 via Wikipedia.
Väteperoxidmolekyl representerad med en sfärer och staplarsmodell. Källa: Benjah-Bmm27 via Wikipedia. -Na2ANTINGEN2: natriumperoxid
-Stråle2: bariumperoxid
-C6H5C (ch3)2OOH: Cummeno hydroperoxid
-(NH4)2S2ANTINGEN8: Ammoniumpersulfat
- Ho3Sooso3H: Peroxidisulfurinsyra
-(Ch3)3Cooc (ch3)3: Ditert-butylperoxid
Referenser
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10th Utgåva.). Wiley Plus.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Organisk peroxid. Hämtad från: i.Wikipedia.org
- Elsevier b.V. (2020). Peroxid. Vetenskaplig. Hämtad från: Scientedirect.com
- Avancerad kemiutveckling. (s.F.). Alkoholer, fenoler och deras härrör:
- Peroxides regel C-218. Återhämtat sig från: acdlabs.com
- Vol'nov i.Yo., Petrocelli a.W. (1966) Klassificering och nomenklatur av oorganiska peroxidföreningar. I: Petrocelli a.W. (Eds) Peroxider, superoxider och ozonider av alkali- och alkaliska jordmetaller. Springer, Boston, MA.
- « Typisk Baja California Sur för män och kvinnor (beskrivning)
- Haloidförsäljningsegenskaper, nomenklatur, hur bildas de, exempel »

