Le Châtelier -principen

- 1208
- 242
- PhD. Emil Svensson
Vad är Le Châteliers princip?
han Le Châtelier -principen Det är en allmän regel som förutsäger effekten att de olika faktorerna som påverkar den kemiska balansen har. I synnerhet hjälper det att förutsäga i vilken riktning en reaktion som är i balans kommer att röra sig när en sådan balans störs av ett externt agent.
Denna princip konstaterar att:
"När ett system som är i jämvikt utsätts för en störning eller en extern spänning, reagerar systemet i den riktning som gör att det delvis kan motverka en sådan störning".
Störning är väl förstått:
- En förändring i koncentrationen av någon av reagensen.
- En förändring i koncentrationen av någon av produkterna.
- Tryckförändringar.
- Volymförändringar.
- En temperaturförändring
När förändringar inträffar som de nämnda, gynnas en av de två reaktionerna, den direkta eller omvända, med avseende på den andra, så att systemet reagerar i den meningen att gå mot ett nytt jämviktstillstånd.
Detta liknar de justeringar som gjorts av en balancer på stram. När tyngdkraften Hala på ena sidan reagerar balansen genom att flytta till motsatt sida. Vi säger att hans balans rörde sig, eftersom han fortfarande är i balans (han faller inte), men nu har han en annan position.
Därefter kommer vi att se hur Le Châtelier -principen används för att förutsäga riktningen i vilken ett system kommer att reagera genom att drabbas av olika typer av spänningar eller störningar som: Förändringar i koncentration, volym, tryck och temperatur.
Effekt av förändringar i koncentrationen
Anta att vi har följande reaktion i balans:
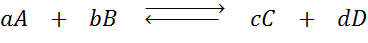
Om vi ändrar koncentrationen av någon av de involverade arterna (a, b, c eller d), förutspår principen om Le Châtelier att systemet kommer att reagera för att motverka denna förändring antingen antingen att konsumera överskottet som har lagts till eller återvinna det eliminerade beloppet. 4 olika situationer kan ges:
1. Ökad koncentration av reagens
Om vi till exempel ökar koncentrationen av ett reagens, till exempel till, enligt principen om Le Châtelier, kommer systemet att reagera för att konsumera det extra överskottet. Detta innebär att det kommer att reagera direkt (från vänster till höger), eftersom denna riktning konsumeras till.
I detta fall sägs det att den direkta reaktionen gynnas och att balansen rörde sig mot produkterna, eftersom koncentrationen av produkter i den nya balansen är större än den i den ursprungliga balansen.
Kan tjäna dig: magnetisk separering2. Ökad koncentration av produkter
Om vi ökar koncentrationen av en produkt, till exempel C, kommer systemet att reagera på baksidan för att konsumera överskottet C tillagd (det vill säga från höger till vänster).
I det här fallet sägs det att den omvända reaktionen gynnas och att balansen rör sig mot reagensen.
3. Minskning av reagenskoncentrationen
Minskningen av koncentrationen har motsatt effekt av ökningen av nämnda koncentration. Om vi drar sig ur mediet och därmed minskar dess koncentration, kommer systemet att reagera på vänster (i omvänd riktning) för att motverka förändringen. Balansen rör sig mot reagensen.
4. Minskning av produktkoncentrationen
Om vi minskar koncentrationen av C eller D kommer systemet att reagera direkt för att ersätta den minskade koncentrationen (det vill säga från vänster till höger). Balansen rör sig mot produkterna.
Exempel:
Bestäm effekten av att tillsätta fler tiocianate -joner (SCN-) I följande kemisk balans, att veta att produkten från höger är intensiv röd och järn (iii) är gul.
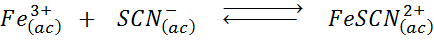
Lösning: I det här fallet lägger vi till tiocianato som är ett reagens, så balansen måste röra sig till höger, öka koncentrationen av komplexet och därför intensiteten hos den röda färgen i lösningen.
Effekt av förändringar i volym och tryck
Förändringar i volym och tryck påverkar inte reaktioner i jämvikt i flytande eller fast tillstånd, men de kan påverka de som finns i ett gasformigt tillstånd. Detta beror på att koncentrationen för gaser är proportionell mot trycket, som förutses av den ideala gaslagen.
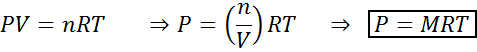
Att öka trycket på en gas som bibehåller den konstant temperaturen motsvarar att minska dess volym, så effekten av båda störningarna kommer att vara densamma.
Om ett totalt tryck ökar till en balansreaktion i jämvikt (eller vi minskar dess volym) kommer systemet att reagera och försöka minska sådant tryck igen, så balansen kommer att flytta till där det finns en mindre mängd gasformiga partiklar molekyler.
Kan tjäna dig: finskiktskromatografi: egenskaper, vad är det för I reaktionen mellan kväve och väte för att bilda ammoniak konsumeras 4 sodamolekyler och endast två produceras, så en ökning av tryck förskjuter balansen mot den mest ammoniakformationen
I reaktionen mellan kväve och väte för att bilda ammoniak konsumeras 4 sodamolekyler och endast två produceras, så en ökning av tryck förskjuter balansen mot den mest ammoniakformationen Om de i reaktionen konsumeras och samma antal gasmolekyler produceras, kommer inte volym- och tryckförändringar att påverka balansen.
Å andra sidan, om vi bara modifierar det partiella trycket för någon av gaserna, är effekten densamma som att öka eller minska koncentrationen av nämnda arter.
Exempel:
Med tanke på nedbrytningsreaktionen av dyitrogentetroxid i balans:
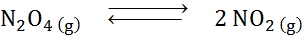
Bestäm effekten av att minska volymen, öka trycket.
Lösning: Om vi ökar det totala systemtrycket eller minskar dess volym, rör sig balansen mot reagensen, eftersom det i den riktningen finns en netto minskning av gasmolekyler (2 och 1) konsumeras 1) vilket gör det möjligt att motverka ökningen i tryck.
Effekten av temperaturförändringar
Effekten av temperatur på kemisk balans skiljer sig från de andra faktorerna som vi hittills har sett. I de tidigare fallen erhålls en ny balans efter störningen, men samma jämviktskonstant upprätthålls. Men om temperaturen förändras kommer jämviktskonstanten att förändras.
För att veta hur jämviktskonstanten förändras med temperaturen måste tecknet på reaktionsentalpin vara känd:
- Om en reaktion frigör värmen, det vill säga den är exoterm, dess entalpi är negativ och jämviktskonstanten minskar när temperaturen ökar. I dessa fall rör sig balansen i motsatt riktning mot reagensen.
- Om en reaktion absorberar värme, det vill säga den är endotermisk, dess entalpi är positiv och det motsatta händer.
Att komma ihåg effekten av temperaturen är lätt om vi betraktar värme som ett reagens som inträffar i fallet med exotermiska reaktioner och konsumeras i fallet med endotermisk. Att öka temperaturen skulle vara som att "tillsätt" värme i systemet och kyla dem skulle vara likvärdiga för att ta bort det.
Så om en reaktion är exoterm och temperaturen ökas, skulle det vara som att lägga till en produkt av reaktionen, så balansen rör sig i motsatt riktning, mot reagensen, och om den svalnar motsatsen.
Det kan tjäna dig: Píchric Acid: Vad är, struktur, syntes, egenskaperÅ andra sidan, om en reaktion är endoterm och temperaturen ökas, skulle det vara som att lägga till ett reagens, så balansen rör sig mot produkterna, medan en minskning av temperaturen har motsatt effekt.
Exempel:
Nedbrytningsreaktionen av N2ANTINGEN4 Den har en +58,0 kJ/mol reaktionsentalpi. I vilken riktning balansen kommer att röra sig om temperaturen minskas?
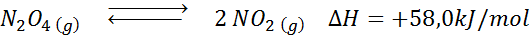
Lösning: Eftersom entalpin är positiv är reaktionen endotermisk. Av denna anledning kommer kylning att gynna omvänd reaktion, och balansen kommer att gå mot reagensen, det vill säga mot bildandet av mer n2ANTINGEN4.
Effekt av katalysatorer, hämmare och inerta ämnen
Katalysatorer och hämmare påverkar hastigheten med vilken reaktioner inträffar, men de påverkar både direkt och indirekt reaktion. Av denna anledning påverkar de inte jämviktstillståndet.
Å andra sidan kommer tillägget av ett inert ämne som en gas som inte reagerar med någon av reagensen eller produkterna inte påverka den direkta eller den direkta reaktionen, så det kommer att ha någon effekt på balansen.
Tillämpning av Le Châteliers princip
Att förstå denna princip är mycket användbar, eftersom det gör att vi kan manipulera tillståndet för en reaktionsbalans på vår bekvämlighet.
I de fall där vi är intresserade.
Detta betyder:
- Lägg till stora mängder reagens, om dessa är ekonomiska.
- Dra tillbaka produkten när reaktionen fortskrider för att upprätthålla systemet i konstant spänningsläge och försöker alltid uppnå balans som reagerar direkt.
- Öka temperaturen i fallet med endotermiska reaktioner.
- Öka trycket på de reaktioner där fler gasmolekyler konsumeras än de inträffar.
Vi kanske också vill minimera mängden för en produkt som bildas av en oönskad reaktion. I dessa fall gör vi motsatsen.
Tillämpningsexempel på Le Châtelier -principen
I organisk syntes används ständigt principen om le châtelier för att förbättra reaktioner ger.
Till exempel, i alkohol dehydratiseringsreaktioner, läggs torkmedel till miljön som absorberar vattnet som bildas under reaktionen. Detta minskar koncentrationen av nämnda produkt, som förskjuter balansen mot produkterna.

