Vad är en isotermisk process? (Exempel, övningar)

- 1651
- 216
- Per Karlsson
han isotermisk process eller isoterm är en reversibel termodynamisk process där temperaturen förblir konstant. I en gas finns det situationer där en förändring i systemet inte ger variationer i temperaturen, utan i fysiska egenskaper.
Dessa förändringar är fasförändringar, när ämnet förändras från fast till vätska, gasvätska eller vice versa. I sådana fall justerar ämnet molekyler deras position, lägger till eller extraherar termisk energi.
 Figur 1. Carambans som smälter är ett exempel på isotermisk process. Källa: Pixabay.
Figur 1. Carambans som smälter är ett exempel på isotermisk process. Källa: Pixabay. Den termiska energin som krävs för att en fasförändring ska ske i ett ämne kallas latent värme eller transformationsvärme.
Ett sätt att få en isotermisk process är att kontakta ämnet som kommer att vara systemet som studeras med en extern termisk insättning, vilket är ett annat stort kaloriskapacitetssystem. På detta sätt inträffar en sådan långsam värmeutbyte att temperaturen förblir konstant.
Dessa typer av processer ges ofta i naturen. Till exempel, hos människor när kroppstemperaturen ökar eller sjunker, känner vi oss sjuka, för i vår kropp ges många kemiska reaktioner som upprätthåller livet vid konstant temperatur. Detta är giltigt för varmt blod i allmänhet.
Andra exempel är is som smälter med värme när våren och isbitarna anländer.
[TOC]
Exempel på isotermiska processer
-Heta blödade djur Metabolism utförs vid konstant temperatur.
 figur 2. Heta blodiga djur har mekanismer för att hålla temperaturen konstant. Källa: Wikimedia Commons.
figur 2. Heta blodiga djur har mekanismer för att hålla temperaturen konstant. Källa: Wikimedia Commons. -När vattnet kokar en fasförändring inträffar, av gasvätska, och temperaturen förblir konstant vid cirka 100 ° C, eftersom andra faktorer kan påverka värdet.
-Isen som smälter är en annan ofta isotermisk process, liksom att placera vatten i frysen för att göra isbitar.
Kan tjäna dig: Geometrisk optik: Vilka studier, lagar, applikationer, övningar-Bilmotorer, kylskåp såväl som många andra typer av maskiner, fungerar korrekt i ett visst temperaturområde. För att upprätthålla lämplig temperatur kallas enheter Termostater. I sin design används olika driftsprinciper.
Carnots cykel
En Carnot -motor är en idealisk maskin från vilken arbete erhålls tack vare helt reversibla processer. Det är en idealisk maskin eftersom den inte tar hänsyn till processer som sprider energi, som en viskositet i ämnet som gör jobbet, och inte heller friktion.
Carnot -cykeln består av fyra steg, varav två är exakt isotermiska och de andra två adiabatiska. De isotermiska stadierna är komprimering och utvidgning av en gas som ansvarar för att producera det användbara arbetet.
En bilmotor fungerar med liknande principer. Rörelsen av en kolv inuti cylindern överförs till andra delar av bilen och producerar rörelse. Det har inte beteendet hos ett idealiskt system som Carnot -motorn, men de termodynamiska principerna är vanliga.
Beräkning av det arbete som utförts i en isotermisk process
För att beräkna det arbete som gjorts av ett system när temperaturen är konstant måste den första termodynamiklagen användas, som säger:
Δu = q - w
Detta är ett annat sätt att uttrycka bevarande av energi i systemet, som presenteras igenom Δu eller förändring i energi, Q som värmen levererades och slutligen W, vilket är det arbete som görs av nämnda system.
Anta att systemet i fråga är en idealisk gas som finns i cylindern i en mobilkolv TILL, Vad fungerar när dess volym V ändring av V1 till V2.
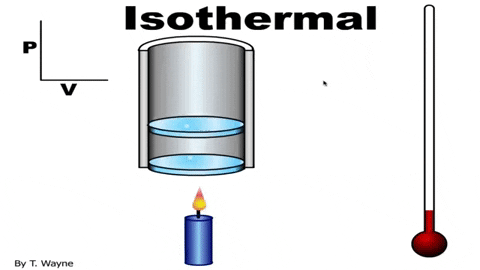 Figur 3. I en isotermisk process expanderar gasen i kolven utan att ändra temperaturen. Källa: YouTube.
Figur 3. I en isotermisk process expanderar gasen i kolven utan att ändra temperaturen. Källa: YouTube. Den ideala gasstatusekvationen är Pv = nrt, som relaterar volymen till trycket P och temperaturen T. Värdena på n och r är konstant: n är antalet mol gas och r gaskonstanten. Vid en isotermisk process är produkten Pv det är konstant.
Kan tjäna dig: Antoinkonstanter: Formler, ekvationer, exempelTja, det utförda arbetet beräknas genom att integrera ett litet differentiellt arbete, där en styrka F producerar en liten DX -förskjutning:
Dw = fdx = padx
Som Adx är precis variationen i volymen Dv, så:
Dw = pdv
För att få totalt arbete i en isotermisk process är DW: s uttryck integrerat:
Trycket P och volymen V De är grafer i ett diagram P-v Som det som visas i figuren och det utförda arbete motsvarar området under kurvan:
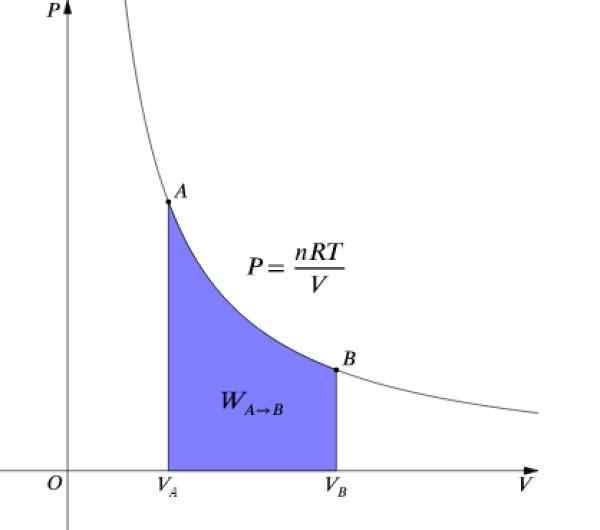 Figur 4. P-V-diagram över en isotermisk process. Källa: Wikimedia Commons.
Figur 4. P-V-diagram över en isotermisk process. Källa: Wikimedia Commons. Som ΔU = 0 Eftersom temperaturen förblir konstant måste den i en isotermisk process:
Q = w
- Övning 1
En cylinder försedd med en mobil kolv innehåller en idealisk gas vid 127 ºC. Om kolven rör sig tills den initiala volymen har reducerats 10 gånger, håll temperaturen konstant, hitta mängden mol som finns i cylindern, om arbetet som gjorts på gasen är 38.180 J.
Faktum: R = 8.3 j/mol. K
Lösning
Uttalandet bekräftar att temperaturen förblir konstant, då är vi i närvaro av en isotermisk process. För det arbete som gjorts på gasen har du den ekvation som tidigare dras av:

127 º C = 127 + 273 K = 400 K
N tydlig, antalet mol:
N = w / rt ln (v2 / v1) = -38180 j / 8.3 j/mol.K x 400 k x ln (v2/10v2) = 5 mol
Ett negativt tecken var före arbetet. Den uppmärksamma läsaren kommer att ha märkt i föregående avsnitt att W definierades som "det arbete som utförts av systemet" och har ett tecken +. Så "arbetet som görs på systemet" har ett negativt tecken.
Det kan tjäna dig: Andra jämviktstillstånd: Förklaring, exempel, övningar- Övning 2
Du har luft i en cylinder försedd med en kolv. Ursprungligen finns det 0.4 m3 av tryck vid 100 kPa och 80 º C temperatur. Luften komprimeras vid 0.1 m3 se till att temperaturen inuti cylindern förblir konstant under processen.
Bestäm hur mycket arbete som görs under denna process.
Lösning
Vi använder ekvationen för det tidigare avdragna arbete, men antalet mol är okänt, vilket kan beräknas med ekvationen för de ideala gaserna:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = p1V1 /Rt = 100000 pa x 0.4 m3 /8.3 j/mol. K x 353 K = 13.65 mol
W = n.R.T ln (v2/V1) = 13.65 mol x 8.3 j/mol. K x 353 K x ln (0.1/0.4) = -55.442.26 J
Återigen indikerar det negativa tecknet att arbetet gjordes på systemet, vilket alltid händer när gas komprimeras.
Referenser
- Bauer, w. 2011. Fysik för teknik och vetenskap. Volym 1. MC Graw Hill.
- Cengel och. 2012. Termodynamik. 7ma Utgåva. McGraw Hill.
- Figueroa, D. (2005). Serie: Physics for Science and Engineering. Volym 4. Vätskor och termodynamik. Redigerad av Douglas Figueroa (USB).
- Riddare, r. 2017. Fysik för forskare och teknik: En strategistrategi.
- Serway, R., Vule, c. 2011. Fysikens grunder. 9na Cengage Learning.
- Wikipedia. Isotermisk process. Hämtad från: i.Wikipedia.org.
- « Acrilonitrilstruktur, egenskaper, produktion, användningar
- På varandra följande meningar vad är och 75 exempel »


