Acrilonitrilstruktur, egenskaper, produktion, användningar

- 4696
- 991
- PhD. Emil Svensson
han akrilonitril Det är en organisk förening vars kondenserade formel är Cho2Chcn. Det är en av de enklaste nitrilerna som finns. Kemi och strukturellt är det inget annat än produkten från unionen mellan en vinylgrupp, Cho2= CH-, och en nitril, cyanidgrupp, C≡N. Det är ett ämne med stor industriell inverkan på plastvärlden.
Fysiskt är det en färglös vätska, med en viss lukt av lök, och det i orena tillstånd presenterar gulaktiga toner. Det är mycket brandfarligt, giftigt och eventuellt cancerframkallande, så det klassificeras som ett extremt farligt ämne. Ironiskt nog är de med det tillverkade plast och leksaker i det dagliga livet, till exempel Tupperware och Lego Blocks.
 Acrilonitrilpolymerer finns i Tupperware -plasten. Källa: Stebulus via Wikipedia.
Acrilonitrilpolymerer finns i Tupperware -plasten. Källa: Stebulus via Wikipedia. På industriella skalor, Acrilonitril. Nästan all den producerade mängden är avsedd för tillverkning av plast, baserat på homopolymerer, såsom polyakrylonitril eller i sampolymerer, såsom akrilonitril-butadienstyren.
[TOC]
Akrilonitrilstruktur
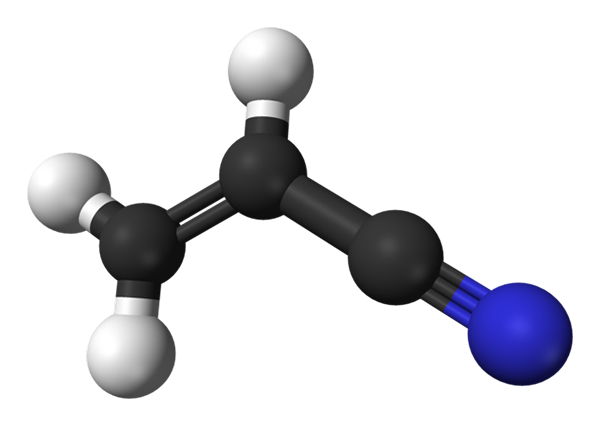 Molekylstruktur av akrilonitril. Källa: Benjah-Bmm27 / Public Domain
Molekylstruktur av akrilonitril. Källa: Benjah-Bmm27 / Public Domain I den övre bilden har vi den akilonitrilmolekylen representerad med en modell av sfärer och staplar. De svarta sfärerna motsvarar kolatomer, medan vita och blå till väte- och kväveatomer, respektive. Vänster, ch2= CH- motsvarar vinylgruppen och höger till cyano-gruppen, C≡N.
Hela molekylen är platt, eftersom vinylgruppens kol har SP -hybridisering2. Samtidigt har Ciano -gruppen kol SP -hybridisering, som är bredvid kväveatomen i en linje som vilar på samma plan som resten av molekylen.
CN -gruppen bidrar med polariteten till molekylen, så molekylen Cho2CHCN upprättar en permanent dipol där den högsta elektroniska densiteten riktas mot kväveatomen. Därför dipol-dipol.
Kan tjäna dig: vad är kemisk periodicitet?Molekylerna ch2CHCN är platta och kan förvänta sig att de i sina kristaller (stelnad vid -84 ºC) är tillgängliga på varandra såsom ark eller pappersark, så att deras dipoler inte avvisar.
Egenskaper
Fysiskt utseende
Färglös vätska men med gulaktiga toner när den presenterar vissa föroreningar. När så rekommenderar de att de destilleras innan det används. Det är flyktigt och har också en intensiv lukt som liknar löken.
Molmassa
53,064 g/mol
Smältpunkt
-84 ºC
Kokpunkt
77 ºC
Flashpoint
-5 ºC (stängd kopp)
0 ºC (öppen kopp)
Självriktningstemperatur
481 ºC
Densitet
0,81 g/cm3
Ång-densitet
1,83 i luftförhållandet.
Ångtryck
109 mmHg vid 25 ºC
Löslighet
I vattnet har det en löslighet av 74 g/L till 25 ºC. Acrilonitril är också betydligt löslig i aceton, olja, etanol, etylacetat och bensen etanil.
Sönderfall
Vid termiskt frisätter toxisk vätecyanid, koloxider och kväveoxider.
Produktion
Sohio -process
Akryitril kan uppstå för massiva skalor genom många reaktioner och kemiska processer. Av dem alla är Sohio -processen den mest använda, som består av den katalytiska amaxideringen av propylen. I en fluidiserad bäddreaktor blandas propylen med luft och ammoniak vid en temperatur runt 400 och 510 ºC, där de reagerar på fasta katalysatorer.
Reaktanterna kommer in i reaktorn en gång och äger rum följande reaktion:
2ch3−ch = ch2 + 2 NH3 + 3 o2 → 2 ch2= CH-C≡N + 6 H2ANTINGEN
Observera att syre reduceras till vatten, medan propylen oxiderar akrilonitril. Därför namnet "amoxidation", eftersom det är en oxidation som involverar deltagande av ammoniak.
Kan tjäna dig: kokning: koncept, typer och exempelAlternativa processer
Förutom Sohio -processen kan andra reaktioner nämnas som tillåter erhållning av akrilonitril. Uppenbarligen är inte alla skalbara, eller åtminstone på ett tillräckligt lönsamt sätt, och inte heller generera produkter med hög prestanda eller renhet.
Akrylonitril syntetiseras, igen från propylen, men gör att den reagerar med kväveoxid på PBO -katalysatorer2-Zro2 luftgelformad. Reaktionen är som följer:
4 ch3−ch = ch2 + 6 Nej → 4 Cho2= CH-C≡N + 6 H2Eller + n2
En reaktion som inte involverar propylen är den som börjar med etenoxid, som reagerar med vätcyanid för att omvandlas till etencyanohydrin; Och senare blir den uttorkad vid en temperatur av 200 ºC i akrilonitrilen:
ETO + HCN → CH2Ohch2Cn
Ch2Ohch2CN + Q (200 ºC) → CH2= CH-C≡N +H2ANTINGEN
En annan mycket mer direkt reaktion är tillsatsen av vätecyanid på acetylen:
HC≡CH + HCN → CH2= CH-C≡N
Många sekundära produkter bildas emellertid, så kvaliteten på akrilonitril är lägre jämfört med Sohio -processen.
Förutom de ovannämnda ämnena, laktonitril, propionitril.
Ansökningar
 Legos tillverkas huvudsakligen med ABS -plast, en sampolymer där akrilonitril är en del. Källa: Pxhere.
Legos tillverkas huvudsakligen med ABS -plast, en sampolymer där akrilonitril är en del. Källa: Pxhere. Acrilonitrile är ett oumbärligt ämne för plastindustrin. Flera av hans härledda plast är mycket kända. Sådant är fallet med akrilonitrilo-butadienstyrensampolymerer (ABS), med vilka bitarna av lekmännen tillverkas. Vi har också akrylfibrer, utarbetade med polyakrylonitrilhomopolymeren (PAN).
Kan tjäna dig: förtvålningBland andra plast som innehåller akrilonitril som en monomer, eller som beror på den för dess tillverkning, har vi: akrylensträckning (SAN), butadien akrylonitril (NBR), akrilonitrilsträckekrylat (ASA), polyakrylamid och syntetiska gummi och nitrilhår.
Praktiskt taget kan alla naturliga polymerer, såsom bomull, modifieras genom att integrera dess molekylstrukturer i akrilonitril. Således erhålls nitrilderivat, vilket gör kemin i den mycket breda akrylonitrilen.
En av dess användningar utanför plastvärlden är som bekämpningsmedel blandat med koltetraklorid. På grund av dess fruktansvärda inverkan på det marina ekosystemet har emellertid sådana bekämpningsmedel förbjudit sig eller är föremål för starka begränsningar.
Risker
Acrilonitrile är ett farligt ämne, så det måste manipuleras med extrem omsorg. Varje olämplig eller alltför långvarig exponering för denna förening kan vara dödlig, antingen genom inandning, intag eller fysisk kontakt.
Det bör hållas så långt som möjligt från alla värmekällor, eftersom det är en flyktig och mycket brandfarlig vätska. Han bör inte heller ha kontakt med vatten, eftersom han reagerar våldsamt med henne.
Utöver detta är det ett eventuellt cancerframkallande ämne, som har associerats med lever- och lungcancer. De som har blivit utsatta för detta ämne har ökningar i nivåerna av tiocyanat utsöndrade i urinen och blodcyanid.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2020). Akrylonitril. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Akrylonitril. Pubchemdatabas., CID = 7855. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Elsevier b.V. (2020). Akrylonitril. Vetenskaplig. Hämtad från: Scientedirect.com
- Korry Barnes. (2020). Vad är akrylonitril? - Användning och egenskaper. Studie. Återhämtat sig från: studie.com
- Pajonk, g.M., Manzalji, t. (1993). Syntes av akrylonitril från propylen och kväveoxidblandningar på PBO2-Zro2 Flygkatalysatorer. Catal Lett tjugoett, 361-369. doi.org/10.1007/BF00769488
- « Dynamiska programmeringsegenskaper, exempel, fördelar, nackdelar
- Vad är en isotermisk process? (Exempel, övningar) »

