Exoterm reaktion
- 2419
- 107
- Hans Olsson
Vi förklarar vilka exotermiska reaktioner, deras egenskaper, skillnader med endotermiska reaktioner är och ger flera exempel
Vad är exotermiska reaktioner?
De exotermiska reaktioner De är kemiska reaktioner som frigör energi i form av värme. Det exotermiska ordet bildas av "Exo" vilket betyder "ut" och "Termos" Vilket betyder värme, så "exoterm reaktion" betyder bokstavligen, reaktion i vilken värme går ut.
Dessa reaktioner är mycket vanliga och vi kan hitta dem överallt, från våra hem till cellerna som är en del av vår kropp.
Hemma kan vi hitta dem i köket när gasen brinner i hornet för att laga maten. Vi hittar dem också inuti bilmotorer när de bränner bränsle.
 Ett exempel på exoterm reaktion
Ett exempel på exoterm reaktion Å andra sidan är exotermiska reaktioner viktiga för livet, eftersom de ger celler den energi de behöver för att leva, växa och reproducera.
Egenskaper för exotermiska reaktioner
De släpper energi i form av värme
Detta är huvudkarakteristiken som gör dem till exotermiska reaktioner.
Den släppta energin kommer från samma reagens
Varje kemisk reaktion kräver att viss aktiveringsenergi inträffar. När det gäller exotermiska reaktioner kommer denna energi från samma reagens när de förvandlas till produkter.
Exotermiska reaktioner Produkter är alltid mer stabila än reagens.
Reagensen genom att bli produkter, förlora en del av sin energi i form av värme. Av denna anledning förblir produkter alltid med mindre energi än reagens, vilket gör dem mer stabila.
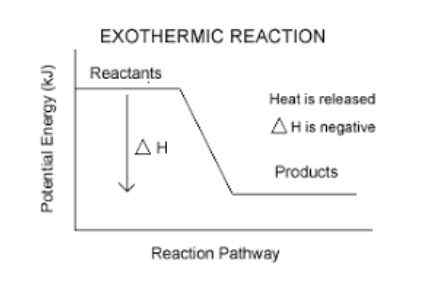
De har en negativ entalpivariation.
Detta är ett enkelt sätt att veta om en reaktion är exoterm eller inte. Varje reaktion som har en AH (läs delta H) negativ, kommer att vara exotermisk.
- Till exempel, Butanens förbränningsreaktion (gasen som vi förbränner i köket) har en entalpivariation på -11.823 kcal/mol. Därför är det en exoterm reaktion.
De behöver bara en trigger för att förekomma i de flesta fall.
Många exotermiska reaktioner behöver bara något som ger dem tillräckligt med energi för att starta. Efter detta räcker samma värme som de släpper ut för att hålla reaktionen att gå.
- Till exempel, Genom att bränna gas behövs bara en gnista, då fortsätter lågan att slå på tills gasen är över.
Skillnader mellan exotermiska reaktioner och endotermiska reaktioner
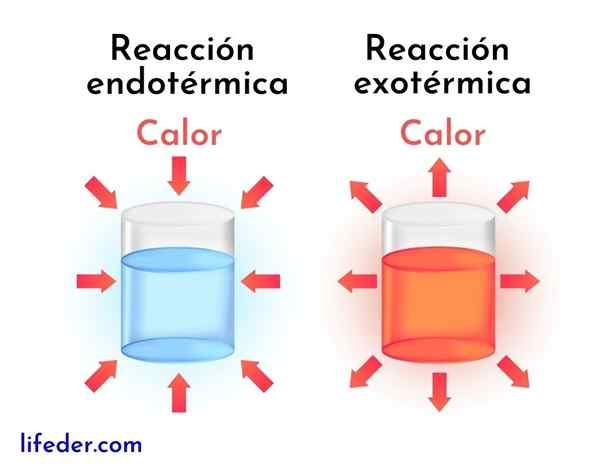
Exotermiska reaktioner är motsatsen till endotermiska reaktioner. I det senare absorberar reagensen energi i form av värme istället för att släppa den, som i exotermiska reaktioner.
Därefter presenteras de viktigaste skillnaderna mellan exotermiska och endotermiska reaktioner:
Exotermiska reaktioner | Endotermiska reaktioner |
De släpper energi i form av värme. | De absorberar energi i form av värme. |
De har en negativ entalpivariation, det vill säga DH<0. | De har en positiv entalpivariation, det vill säga Dh> 0. |
De tenderar att öka den omgivande temperaturen. | De tenderar att minska temperaturen eller svalna runt. |
Energin som håller reaktionen att gå kommer från samma reagens. | Energin som håller reaktionen att gå kommer från omgivningen. |
Mer stabila produkter erhålls alltid med mindre energi. | Mindre stabila produkter erhålls alltid med en högre energinivå. |
Exempel på exotermiska reaktioner
Förbränning av köksgas
I de flesta hem i världen är gasen som används för att laga mat butan, som har molekylformeln C4H10. Detta kolväte bränns med luftens syre med hjälp av nästa förbränningsreaktion som släpper stora mängder värme:
Kan tjäna dig: Enkelt mikroskop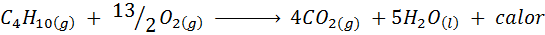
Explosionen av dynamit
Dynamite innehåller ett explosivt som kallas nitroglycerin (c3H5N3ANTINGEN9). Denna sammansättning sönderdelas mycket våldsamt och släpper stora mängder värme, vilket orsakar en stor explosion. Den kemiska reaktionen är:
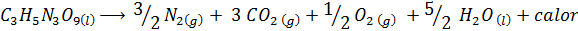
Denna reaktion har en ΔH = -368 kcal⁄mol, Så det är en exoterm reaktion.
Spontan förbränning av vit fosfor
Fosforelementet (P) kan hittas som röd fosfor eller vit fosfor. Vit fosfor. Reaktionen är:
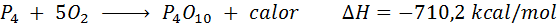
Cellandning
Cellulär andning är en exoterm kemisk reaktion som består i oxidationen av maten vi äter. Värmen som frigörs av denna reaktion används av celler för att utföra oändliga endotermiska kemiska reaktioner som kräver att energi inträffar.
Fyrverkeri
Fyrverkerier innehåller svart krutt som den huvudsakliga explosiva komponenten. Gunpowder är en blandning som innehåller kaliumnitrat, grafit och svavelkol som reagerar med varandra genom en exoterm reaktion. Värmen som denna reaktion frigör, genererar det stora utbudet av färger som vi ser i himlen när fyrverkerier exploderar.
Den kemiska termiska dynan
Termiska dynor används som heta kompresser för att lindra sportskador. Dessa består av en förseglad påse som innehåller vatten och en kemist i ett litet rör. När röret är trasigt blandas kemisten med att vattnet ger en exoterm kemisk reaktion som värmer dynan.
Metallisk natriumreaktion med vatten
Natrium (NA) är en mycket reaktiv alkalisk metall som när man kommer i kontakt med vatten reagerar våldsamt och släpper mycket värme och gasformigt väte. Reaktionen är:
Det kan tjäna dig: metoder för separering av heterogena blandningar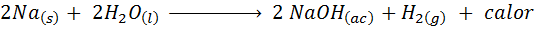
Denna reaktion frigör 1900 kalorier för varje gram NA som reagerar med vatten. Detta innebär att 1 gram natrium skulle räcka för att värma 3 medelstora kaffekoppar.
Tvättmedelsupplösning
Detta är en reaktion som vem som helst kan uppleva i sitt hem. När du tar en handfull dammande tvättmedel för att tvätta kläder och våta det med lite vatten, kommer handen omedelbart att känna sig het. Detta beror på att processen för upplösning av tvättmedlet i vatten är exotermiskt.
Trimita -reaktionen
Termita är en blandning av aluminium i form av ett mycket fint pulver och en oxid av en annan metall som järn. Efter en gnista är reaktionen som inträffar:
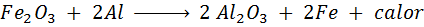
Denna reaktion frigör så mycket värme, som kan smälta järn och används mycket för att svetsa tågskenor.
Vattenkondens
För alla ämnen, gasfasförändringar (kondens), vätska till fast (stelning) och fast gas (avsättning), släpp alltid värme och är därför exotermiska processer. När det gäller vatten släpper kondensationen av bara 18 gram vatten cirka 10.000 kalorier, vilket räcker för att värma 15 små kaffekoppar.
Referenser
- Chang, R. och Goldsby, K. (2014). Kemi. 11: e upplagan. New York: McGraw-Hill Education.
- Exoterm reaktion (2020, 19 december). I Wikipedia. Tagen från.Wikipedia.org
- Holmes, w. S. (1963). Förbränning av fosfor och entalpierna för bildning av P4O10 och H3PO4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada s. från en., F. Yo. (2014). Smällare, raketer och mycket kemi. Kemisk utbildning. 44-51. Doi: 10.2436/20.2003.02.134
- Termitreaktion. University of Minnesota (Institutionen för kemi). Hämtad från kem.Umn.Edu

