Renio Discovery, Egenskaper, struktur, användningar

- 4857
- 279
- Erik Eriksson
han Renio Det är ett metalliskt element vars kemiska symbol är RE och ligger i grupp 7 i det periodiska tabellen, två positioner under mangan. Dela med detta och Technecio -ägandet av flera nummer eller oxidationstillstånd, från +1 till +7. Bildar också en anjon som heter Perrenato, fången4-, Analog med permanganat, MnO4-.
Denna metall är en av de mest sällsynta och knappa till sin natur, så priset är högt. Det extraheras som en biprodukt av molybden och kopparbrytning. En av de mest relevanta egenskaperna hos Renio är dess höga smältpunkt, knappt övervunnen av kol och volfram, och dess stora densitet, som är dubbelt så stor som bly.
 Reniometallsfär. Källa: Hi-reser Bilder av kemiska element/cc av (https: // CreativeCommons.Org/licenser/av/3.0)
Reniometallsfär. Källa: Hi-reser Bilder av kemiska element/cc av (https: // CreativeCommons.Org/licenser/av/3.0) Hans upptäckt har kontroversiella och olyckliga nyanser. Namnet på "Renio" härstammar från det latinska ordet "Rhenus", vilket betyder Rin, den berömda tyska floden nära platsen där de tyska kemisterna som isolerade och identifierade detta nya element fungerade.
Renio har många användningsområden, bland vilka förfining av oktanen av bensinstativ.
[TOC]
Upptäckt
Förekomsten av två tunga element med kemiska egenskaper som liknar de hos mangan förutspådde redan sedan 1869, genom den periodiska tabellen för den ryska kemisten Dmitri Mendeleev. Det var emellertid inte känt vad deras atomantal skulle vara; Och det var här 1913 när förutsägelsen av den engelska fysikern Henry Moseley introducerades.
Enligt Moseley måste dessa två element som tillhör mangangruppen ha atomnummer 43 och 75.
Ett par år innan hade emellertid den japanska kemisten Masataka Ogawa upptäckt det påstådda elementet 43 i ett urval av Mineral Torianita. Efter att ha meddelat sina resultat 1908 ville han döpa detta element med namnet 'Niponio'. Tyvärr visade kemisterna vid den tiden att Ogawa inte hade upptäckt element 43.
Det kan tjäna dig: cykloalques: kemisk struktur, egenskaper, nomenklaturOch så, andra år gick när 1925 tre tyska kemister: Walter Noddack, Ida Noddack och Otto Berg, hittade element 75 i Columbita, Gadolinite och Molybdenite Mineral Prover. Dessa gav honom namnet Renio, för att hedra Rin Rin i Tyskland ('Rhenus', på latin).
Masataka Ogawas fel var att få Disace avstängd vid identifieringen av elementet: han hade upptäckt Renio, inte element 43, kallad Tecnecio idag.
Renioegenskaper
 Renio -situationen i det periodiska tabellen. !Original: Ahoteseiervector: Sushant Savla/CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)
Renio -situationen i det periodiska tabellen. !Original: Ahoteseiervector: Sushant Savla/CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0) Fysiskt utseende
Renio marknadsförs vanligtvis i form av gråaktigt damm. Dess metallbitar, vanligtvis sfäriska droppar, är silvergrå, som också är mycket ljusa.
Molmassa
186 207 g/mol
Atomnummer
75
Smältpunkt
3186 ºC
Kokpunkt
5630 ºC
Densitet
-Vid rumstemperatur: 21,02 g/cm3
-Rätt vid smältpunkten: 18,9 g/cm3
Renio är en metall som är nästan dubbelt så tät än samma ledning. Således kan en Renio -sfär som väger 1 gram likställas med en robust blykristall av samma massa.
Elektronnegativitet
1.9 På Pauling -skalan
Joniseringsenergier
Först: 760 kJ/mol
Andra: 1260 kJ/mol
Tredje: 2510 kJ/mol
Molvärmekapacitet
25.48 J/(mol · k)
Värmeledningsförmåga
48,0 W/(M · K)
Elektrisk resistans
193 nΩ · m
Mohs hårdhet
7
Isotoper
Renio -atomer presenteras i naturen som två isotoper: 185Re, med ett överflöd på 37,4%; och 187Re, med ett överflöd på 62,6%. Renio är ett av de element vars vanligaste isotop är radioaktiv; Men halvlivstiden för 187Re är mycket stor (4,12 · 1010 år), så det anses praktiskt betraktas som stabilt.
Kan tjäna dig: nickel: historia, egenskaper, struktur, användningar, riskerReaktivitet
Metallisk renio är en materiell resistent mot oxidation. När han gör det, hans oxid, re2ANTINGEN7, Det är förångat vid höga temperaturer och brännskador med en gulaktig grön låga. Renios bitar motstår HNO: s attack3 koncentrerad; Men varmt, upplöses för att generera reninsyra och kvävedioxid, som färgbrun lösningen:
Re + 7hno3 → Hreo4 + 7 Nej2 + 3 timmar2ANTINGEN
Renios kemi är enorm, eftersom den kan bilda föreningar med ett brett spektrum av oxidationsnummer, samt etablera en quadrupolo-bindning mellan två renio-atomer (fyra re-re-kovalenta bindningar).
Elektronisk struktur och konfiguration
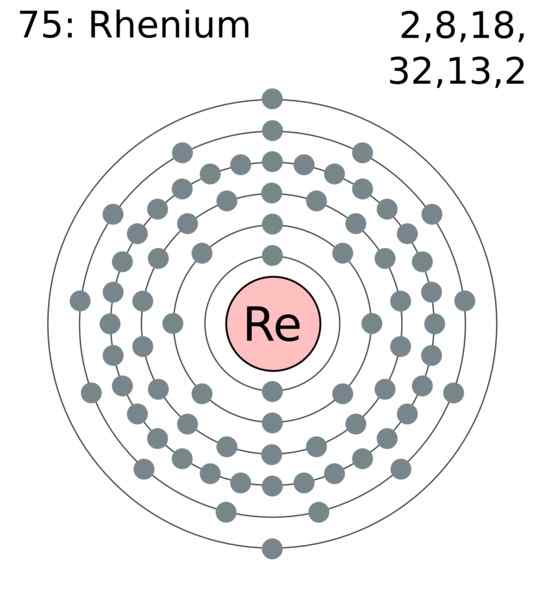 Reniolektronskikt. Författare: Användare: GREGROBSON (Greg Robson). Wikimedia Commons
Reniolektronskikt. Författare: Användare: GREGROBSON (Greg Robson). Wikimedia Commons Renio -atomer grupperas i sina kristaller för att orsaka en kompakt hexagonal struktur, HCP, som kännetecknas av att vara mycket tät. Detta överensstämmer med att vara en metall med stor densitet. Den metalliska länken, produkten av överlappningen av dess yttre orbitaler, håller atomerna starkt sammanhängande.
I denna metalliska länk, åter, deltar elektronerna i Valencia, som är enligt den elektroniska konfigurationen:
[Xe] 4f14 5 D5 6s2
I princip är det 5D- och 6S -orbitaler som överlappar för att kompaktera reatomerna i HCP -strukturen. Observera att dina elektroner lägger till totalt 7, motsvarande din grupps nummer i det periodiska tabellen.
Oxidationsnummer
Renio elektronisk konfiguration glimtar en gång att dess atom kan förlora upp till 7 elektroner, för att bli den hypotetiska katjonen7+. När förekomsten av RE antas7+ I någon renioförening, till exempel i RE2ANTINGEN7 (Re27+ANTINGEN72-), Det sägs att det har ett oxidationsnummer +7, RE (VII).
Andra positiva oxidationsnummer för renio är: +1 (re+), +2 (Re2+), +3 (re3+), Och så vidare till +7. På samma sätt kan Renio få elektroner att bli en anjon. I dessa fall sägs det att det har ett negativt oxidationsnummer: -3 (re3-), -2 (re2-) och -1 (re-).
Det kan tjäna dig: Hydrolys: Vad är det och exempel på reaktionerAnsökningar
Bensin
Renio, tillsammans med platina, används för att skapa katalysatorer som ökar graden av oktan av bensin, medan det minskar blyinnehållet. Å andra sidan är reniokatalysatorer avsedda för flera hydreringsreaktioner, detta på grund av deras resistens mot förgiftning av kväve, fosfor och svavel.
Eldfast superleations
Renio är en eldfast metallprodukt av sin höga smältpunkt. Det är därför nicklegeringar läggs till för att vända dem eldfasta och motståndskraftiga mot stora tryck och temperaturer. Dessa superleationsverk används mest för utformning av turbiner och motorer för flyg- och rymdfartyg.
Volframfilament
Renio kan också bilda legeringar med volfram, vilket förbättrar dess duktilitet och underlättar därför tillverkningen av filament. Dessa renio-volframfilament används som röntgenkällor och för utformningen av termokapla som kan mäta temperaturer upp till 2200 ° C.
På samma sätt användes dessa renio -filament en gång för arkaiska kameror blinkar och för närvarande för sofistikerade utrustningslampor; såsom masspektrofotometer.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Sarah Pierce. (2020). Rhenium: Användning, historia, fakta och isotoper. Studie. Återhämtat sig från: studie.com
- Nationellt centrum för bioteknikinformation. (2020). Renium. Pubchemdatabas., CID = 23947. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2020). Renium. Hämtad från: i.Wikipedia.org
- Doktor. Doug Stewart. (2020). Rheniumelement fakta. Återhämtat sig från: Chemicool.com
- ERIC SCERRI. (18 november 2008). Renium. Kemi i sina element. Återhämtat sig från: Chemistryworld.com
- « Inga karakteristiska elektrolyter och exempel
- Alfa-Cootogl Egenskaper, funktioner och applikationer »

