Rubidio Historia, egenskaper, struktur, erhållning, användning

- 3819
- 746
- PhD. Emil Svensson
han rubidium Det är ett metalliskt element som tillhör grupp 1 i det periodiska tabellen: det för alkaliska metaller, som representeras av RB -kemisk symbol. Hans namn låter som Rubí, och det beror på att när hans utsläppsspektrum upptäcktes visade han intensiva röda karakteristiska linjer.
Det är en av de mest reaktiva metallerna som finns. Det är den första av alkaliska metaller som, trots att de är lite täta, sjunker i vattnet. Det reagerar också med henne mer explosivt jämfört med litium, natrium och kalium. Det har funnits experiment där ampulorna lagras (lägre bild) för att falla och explodera i badkar.
 Ampull med ett gram rubidium lagrat under en inert atmosfär. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]
Ampull med ett gram rubidium lagrat under en inert atmosfär. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] Rubidio kännetecknas av att vara en metall dyrare än samma guld; Inte så mycket för sin brist, men för dess breda mineralogiska fördelning i jordskorpan och svårigheterna som uppstår när man isolerar den av kalium och upphör att föreningar.
Det visar en tydlig tendens att associera med kalium i sina mineraler och hitta som föroreningar. Inte bara i geokemiskt material bildar en duo med kalium, utan också inom biokemi.
Organismen "förvirrar" K -jonerna+ För RB+; Rubidio är emellertid inte ett väsentligt element hittills, eftersom det är okänt vilken roll han spelar i metabolism. Trots detta har rubidiumtillskott använts för att lindra vissa medicinska tillstånd som depression och epilepsi. Å andra sidan avfyrar båda jonerna en violett låga i tändarens värme.
På grund av dess höga kostnader baseras inte dess tillämpningar för mycket i syntesen av katalysatorer eller material, men som en komponent för olika enheter med fysiska teoretiska baser. En av dem är atomklockan, solceller och magnetometrar. Det är därför rubidium ibland tas som en underskattad eller lite studerad metall.
[TOC]
Historia
Rubidio upptäcktes 1861 av tyska kemister Robert Bunsen och Gustav Kirchhoff, med spektroskopi. För att göra detta använde de Bunsen -tändaren och spektroskopet, uppfann två år innan, utöver analytiska utfällningstekniker. Studieobjektet var Lepidolite Mineral, vars visar samlingen av Sachsen, Tyskland.
De började från 150 kg lepidolitmineral, som de behandlade med kloroplatinsyra, h2Ptcl6, För att fälla ut kaliumhexakloroplatinaten, k2Ptcl6. Men när de studerade sitt spektrum genom att bränna det i Bunsen -tändaren, insåg de att de uppvisade utsläppslinjer som inte sammanfallde då med något annat element.
Utsläppsspektrumet för detta nya element kännetecknas av att ha två väldefinierade linjer i den röda regionen. Det är därför han döptes med namnet 'Rubidus' som betyder 'mörkröd'. Sedan lyckades Bunsen och Kirchhoff separera RB2Ptcl6 av k2Ptcl6 genom fraktionerad kristallisation; För att äntligen reducera det till ditt kloridsalt med väte.
Identifierade och isolerade ett salt av det nya Rubidio -elementet, tyska kemister behövde bara reducera det till sitt metalliska tillstånd. För att uppnå detta försökte de på två sätt: Applicera elektrolys på rubidiumklorid eller värma ett enkelt salt att minska, till exempel Tartrato. Således föddes Metallic Rubidio.
Fysiska och kemiska egenskaper
Utseende
Silvergrå metall. Det är så mjukt att det ser ut som ett smör. Det är vanligtvis förpackat inuti glasampulor, inom vilka en inert atmosfär dominerar som skyddar den från att reagera med luft.
Atomantal (z)
37
Molmassa
85,4678 g/mol
Smältpunkt
39 ºC
Kokpunkt
688 ºC
Densitet
Vid rumstemperatur: 1 532 g/cm3
Vid smältpunkten: 1,46 g/cm3
Rubidiums täthet är överlägsen den för vatten, så det kommer att sjunka medan det reagerar våldsamt med det.
Fusionsvärme
2,19 kJ/mol
Förångningsvärme
69 kJ/mol
Elektronnegativitet
0,82 på Pauling -skalan
Elektronisk affinitet
46,9 kJ/mol
Joniseringsenergier
-Först: 403 kJ/mol (RB+ gasformig)
-Andra: 2632.1 kJ/mol (RB2+ gasformig)
-Tredje: 3859,4 kJ/mol (RB3+ gasformig)
Atomradio
248 PM (empirisk)
Värmeledningsförmåga
58.2 W/(M · K)
Elektrisk resistans
128 nΩ · m vid 20 ° C
Mohs hårdhet
0,3. Därför är till och med talk svårare än metalliskt rubidium.
Reaktivitet
 Låga repetition för rubidium. När han reagerar säger han adjö till en violett låga. Källa: Didaktische.Medien [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Låga repetition för rubidium. När han reagerar säger han adjö till en violett låga. Källa: Didaktische.Medien [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Rubidio är en av de mest reaktiva alkaliska metallerna, efter Cesio och Francio. Han är knappt utsatt för luften börjar brinna, och om han är helig skjuter han lysande gnistor. Om han är uppvärmd avger han också en violett låga (överlägsen bild), vilket är ett positivt test för RB -joner+.
Kan tjäna dig: ididio 192Reagerar med syre för att bilda en blandning av peroxider (RB2ANTINGEN2) och superoxider (RBO2). Även om det inte reagerar med syror och baser, kränker det det med vatten, vilket genererar rubidium och vätgas gashydroxid:
Rb (s) + h2Eller (l) => rboh (ac) + h2(g)
Reagerar med väte för att bilda dess motsvarande hydrid:
Rb (s) + h2(g) => 2rbh (s)
Och även med halogener och svavel explosivt:
2RB (S) + Cl2(g) => rbcl (s)
2rb (s) + s (l) => rb2H.H)
Även om Rubidium inte betraktas som ett giftigt element, är det potentiellt farligt och representerar brandrisker när det kommer i kontakt med vatten och syre.
Elektronisk struktur och konfiguration
Rubidio -atomer är arrangerade på ett sådant sätt att de etablerar en kubisk struktur kristall centrerad i kroppen (BCC). Denna struktur är karakteristisk för alkaliska metaller, som är lätta och tenderar att flyta över vatten; Förutom Rubidium down (Cesio och Francio).
I Rubidio BCC -kristaller interagerar deras RB -atomer med varandra tack vare den metalliska länken. Detta styrs av ett "hav av elektroner" av dess valenslager, från 5S -orbital enligt dess elektroniska konfiguration:
[KR] 5S1
Alla 5S -orbitaler med sin enda elektron är överlappning i alla dimensioner av Rubidio Metal Crystals. Dessa interaktioner är emellertid svaga, eftersom när gruppen av alkaliska metaller är härstammade blir orbitalerna mer diffusa och därför försvagas den metalliska länken.
Det är därför smältpunkten för rubidiet är 39 ºC. Dessutom förklarar dess svaga metallbindning mjukheten i dess fasta; Så mjukt att det verkar vara ett silversmör.
Det finns inte tillräckligt med bibliografisk information om beteendet hos deras kristaller under högt tryck; Om det finns tätaste faser med unika egenskaper som med natrium.
Oxidationsnummer
Dess elektroniska konfiguration indikerar en gång att Rubidium starkt tenderar att förlora sin enda elektron för att bli isolektronisk till Noble Gas Kripton Gas. När den gör det bildas den monovalenta katjonen RB+. Det sägs att det i dess föreningar har oxidationsnummer +1 när förekomsten av denna katjon antas.
På grund av rubidiumens trend att oxidera, antagandet att det finns RB -joner+ I dess föreningar är det framgångsrikt, vilket i sin tur påpekar den joniska karaktären hos dessa föreningar.
I nästan alla föreningar av rubidiet uppvisar detta ett oxidationsnummer +1. Exempel på dem är följande:
-Rubid Chloride, RBCL (RB+Kli-)
-Rubidio Hydroxide, Rboh (RB+ Åh-)
-Rubidio karbonat, RB2Co3 (RB2+Co32-)
-Rubidio Monoxide, RB2Eller (RB2+ANTINGEN2-)
-Rubidium superoxid, RBO2 (RB+ANTINGEN2-)
Även om det är mycket sällsynt kan rubidiet också ha ett negativt oxidationsnummer: -1 (RB-). I det här fallet skulle vi prata om en "rubidiuro" om han bildade förening med ett mindre elektronegativt element än honom, eller om han skickade under speciella och rigorösa förhållanden.
Kluster
Det finns föreningar där varje Rb -atom har oxidationsnummer med fraktionella värden. Till exempel i RB6Eller (RB62+ANTINGEN2-) och RB9ANTINGEN2 (RB94+ANTINGEN22-) Den positiva belastningen fördelas mellan en uppsättning RB -atomer (kluster). Således i RB6Eller oxidationsnumret i teorin skulle vara +1/3; Medan i RB9ANTINGEN2, + 0,444 (4/9).
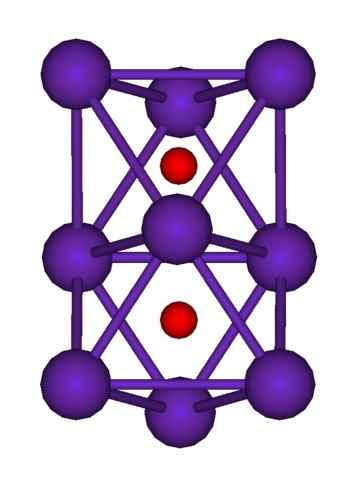 RB9O2 klusterstruktur. Källa: Axiosaurus [Public Domain]
RB9O2 klusterstruktur. Källa: Axiosaurus [Public Domain] RB -klusterstrukturen visas ovan9ANTINGEN2 representerad av en sfärer och staplarsmodell. Observera hur de nio RB -atomerna "omsluter" anjonerna eller2-.
Som evighet är det som om en del av de ursprungliga metallkristallerna i rubidiet förblev oförändrade medan han skilde sig från moderkristallen. De förlorar elektroner i processen; de som är nödvändiga för att locka eller2-, och den resulterande positiva laddningen distribueras bland alla atomerna i nämnda kluster (uppsättning eller aggregat av RB -atomer).
I dessa rubidiumkluster kan således förekomsten av RB inte antas formellt+. RB6Eller och RB9ANTINGEN2 De klassificeras som rubidiumsuboxider, där denna uppenbara avvikelse uppfylls för att ha ett överskott av metallatomer i förhållande till oxider -anjoner.
Var är det och få
jordskorpa
 Lepidolitmineralprov. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Lepidolitmineralprov. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Rubidio är det vanligaste elementet 23 i jordskorpan, med ett överflöd som kan jämföras med zink-, bly-, cesium- och kopparmetaller. Detaljen är att deras joner sprids allmänt, så den dominerar inte i något mineral som ett huvudmetalliskt element, och deras malmer är också knappa.
Kan tjäna dig: Grignard Reagent: Förberedelse, applikationer, exempelDet är av denna anledning som Rubidio är en mycket dyr metall, ännu mer än samma guld, eftersom dess process att få från sina menas är komplex på grund av svårigheten med dess exploatering.
I naturen, med tanke på dess reaktivitet, är rubidium inte i ett infödda tillstånd, utan som oxid (RB2O), klorid (RBCL) eller åtföljd av andra anjoner. Dess "fria" RB -joner+ De är i havet med en koncentration av 125 ug/L, liksom i de varma källorna och floderna.
Bland mineralerna i jordskorpan som innehåller den i en koncentration av mindre än 1% har vi:
-Leucita, K [alsi2ANTINGEN6]
-Polucita, CS (ja2Hallå6· NH2ANTINGEN
-Karnalita, kmgcl3· 6h2ANTINGEN
-Zinnwaldita, klifeal (ALSI3)ANTINGEN10(Åh, f)2
-Amazonita, PB, Kalsi3ANTINGEN8
-Petalita, lialsi4ANTINGEN10
-BioTita, K (MG, Faith)3Alsi3ANTINGEN10(Åh, f)2
-Rubiclina, (RB, K) ALSI3ANTINGEN8
-Lepidolita, K (Li, AL)3(Ja, Al)4ANTINGEN10(F, oh)2
Geokemisk förening
Alla dessa mineraler delar en eller två saker gemensamt: de är kalium-, cesium- eller litiumsilikater, eller är mineralsalter av dessa metaller.
Detta innebär att Rubidio har en stark tendens att associera med kalium och cesio; Det kan till och med ersätta kalium under kristallisationen av mineraler eller stenar, eftersom det händer i fälten på Pegmatitas när magma kristalliseras. Således är Rubidio en biprodukt av exploatering och raffinering av dessa stenar och deras mineraler.
Rubidio kan också vara i vanliga bergarter som granit, leror och basalt och till och med kolhaltiga avlagringar. Av alla naturliga källor representerar lepidolit sin huvudmalm och från vilken den är kommersiellt utnyttjad.
I karnaliten kan å andra sidan Rubidio hittas som RBCL föroreningar med ett innehåll på 0,035%. Och i större koncentration finns det avlagringarna av Polucitas och Rubiclinas, som kan ha upp till 17% av Rubidium.
Dess geokemiska förening med kalium beror på likheten mellan dess joniska radioapparater; RB+ är större än k+, Men skillnaden i storlekar är inte ett hinder för den första som ersätter den andra i sina mineralkristaller.
Fraktionerad kristallisation
Oavsett om det är baserat på lepidolit eller polucita, eller någon av de mineraler som nämns ovan, förblir utmaningen densamma i större eller mindre grad: att separera rubidiet från kalium och cessium; Det vill säga, applicera blandningsseparationstekniker som tillåter föreningar eller salter av rubidium å ena sidan och kalium och cesium, å andra sidan.
Detta är svårt eftersom dessa joner (k+, RB+ och CS+) dela en stor kemisk likhet; De reagerar på samma sätt för att bilda samma salter, som knappt skiljer sig från varandra tack vare deras täthet och lösligheter. Det är därför fraktionerad kristallisation används, så att de långsamt kan och kontrolleras.
Till exempel används denna teknik för att separera en blandning av karbonater och alum från dessa metaller. Omkristalliseringsprocesser bör upprepas flera gånger för att garantera ultimata och fria kristaller av samutfällda joner; Ett rubidiumsalt som kristalliseras med K -joner+ eller CS+ på ytan eller inuti.
Mer moderna tekniker, såsom användning av ett jonbytesharts, eller kronor som komplexa medel, tillåter också RB -joner+.
Elektrolys eller reduktion
När det har varit möjligt att separera och rena Rubid -saltet är nästa och sista steg att minska katjonerna RB+ till fast metall. För att göra detta smälter saltet och utsätts för elektrolys för att fälla ut rubidium i katoden; eller ett starkt reducerande medel, såsom kalcium och natrium, används, som kan förlora elektroner snabbt och därmed minska rubidiet.
Isotoper
Rubidio finns på jorden som två naturliga isotoper: 85RB och 87RB. Den första har ett överflöd på 72,17%, medan den andra av 27,83%.
han 87RB ansvarar för att denna metall är radioaktiv; Men strålningen är ofarlig och till och med fördelaktig för dejtinganalys. Din halvliv (t1/2är 4,9 · 1010 år, vars tid överstiger universums ålder. När det sönderfaller blir det den stabila isotopen 87herr.
Tack vare detta har denna isotop använts för att träffa åldern för mineraler och landstenar som finns sedan jordens början.
Förutom isotoperna 85RB och 87RB, det finns andra syntetiska och radioaktiva med variabla och mycket kortare livstider; Till exempel honom 82RB (t1/2= 76 sekunder), 83RB (t1/2= 86,2 dagar), 84RB (t1/2= 32,9 dagar) och 86RB (t1/2= 18,7 dagar). Av dem alla, 82RB är det mest använda i medicinska studier.
Risker
Metall
Rubidio är en så reaktiv metall att den måste förvaras i glasampulor under en inert atmosfär så att den inte reagerar med luftens syre. Om nämnda ampullar bryts, kan metallen placeras i fotogen eller mineralolja för att skydda den; Det kommer emellertid att i slutändan oxidera det upplösta syre i dem, vilket ger upphov till rubidiumperoxider.
Det kan tjäna dig: natriumcyanid (NACN): struktur, egenskaper, risker, användningarOm det tvärtom beslutades att placera det på trä, till exempel kommer det att brinna med en violett låga. Om det finns mycket fukt, kommer det att brinna med det faktum att bli utsatt för luften. När en stor bit rubidium undviks vid en volym vatten, utnyttjar den kraftigt och når väteproducerad gas i eld.
Därför är rubidium en metall som bör manipulera, eftersom alla dess reaktioner är praktiskt taget explosiva.
Joner
Till skillnad från metalliskt rubidium, dess RB -joner+ De representerar inte någon uppenbar risk för levande varelser. Dessa upplösta i vatten interagerar med cellerna på samma sätt som K -jonerna gör+.
Därför har rubidium och kalium liknande biokemiska beteenden; Rubidium är dock inte ett väsentligt element, medan kalium ja. På detta sätt+ De kan ackumuleras i interiören i cellerna, röda blodkroppar och viscera utan att påverka något djurs kropp negativt.
I själva verket har det uppskattats att en vuxen man med en massa på 80 kg innehåller cirka 37 mg Rubidio; Och att en ökning av denna koncentration i storleksordningen 50 till 100 gånger leder inte till oönskade symtom.
Men ett överskott av Rb -joner+ kan i slutändan flytta till K -joner+; Och följaktligen kommer individen att drabbas av mycket starka muskelspasmer fram till döden.
Logiskt sett kan Salvorsalter eller föreningar av rubidium utlösa detta omedelbart, så ingen av dem bör intas. Dessutom kan det orsaka enkla kontaktförbränningar och bland de mest giftiga fluoriden (RBF), hydroxid (RBOH) och cyanid (RBCN) av rubidium.
Ansökningar
Gassamlare
Rubidio har använts för att fånga eller eliminera spåren av gaser som kan existera i de vakuumförseglade rören. Precis på grund av deras höga tendens att fånga syre och fukt i dem eliminerar de dem på sin yta som peroxider.
Pyroteknik
När Rubidio-salter bränner en karakteristisk violetta-Reddisk låga. Vissa fyrverkerier har dessa salter i sin komposition så att de exploderar med dessa färger.
Tillägg
Rubidio -klorid har förskrivits för att bekämpa depression, eftersom studier bestämde ett underskott av detta element hos individer som lider av detta medicinska tillstånd. Det har också använts som lugnande medel och för att behandla epilepsi.
Bose-Einstein kondensat
Isotopatomerna 87RB användes för att skapa det första Bose-Einstein-kondensatet. Detta tillståndstillstånd är att atomer vid en temperatur som är ganska nära absolut noll (0 k), grupperas eller "kondensan", uppför sig som om de var en.
Således var Rubidio huvudpersonen i denna triumf inom fysikområdet, och det var Eric Cornell, Carl Wieman och Wolfgang Ketterle som fick Nobelpriset 2001 tack vare detta arbete.
Tumördiagnos
Den syntetiska radioisotopen 82RB sönderfaller genom att avge positroner, som används för att samlas i kalium -rika vävnader; Som de som ligger i hjärnan eller hjärtat. Det används därför för att analysera hjärtans funktionalitet och närvaron av möjliga tumörer i hjärnan genom positronemissionstomografi.
Komponent
Rubidio -joner har hittat utrymme i olika typer av material eller blandningar. Till exempel har deras legeringar med guld, cesium, kvicksilver, natrium och kalium gjorts. Det har antagits till glas och keramik för att öka sin smältpunkt.
I Perovskitas solceller har de lagts till som en viktig komponent. På samma sätt har dess möjliga användning studerats som termoelektrisk generator, värmeöverföringsmaterial i rymden, bränsle i joniska framdrivningsmotorer, elektrolytiskt medium för alkaliska batterier och atommagnetometrar.
Atomur
Med rubidium och upphör har de berömda atomklockorna tillverkats, mycket exakta, används till exempel i GPS -satelliter som ägarna till deras smartphones kan känna till sin plats medan de rör sig på en väg.
Referenser
- Bond Tom. (29 oktober 2008). Rubidium. Återhämtat sig från: Chemistryworld.com
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Rubidium. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Rubidium. Pubchemdatabas. CID = 5357696. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Chellan, s., & Sadler, s. J. (2015). Elementen i livet och läkemedel. Filosofiska transaktioner. Serie A, Mathematic, Physical and Engineering Sciences, 373 (2037), 20140182. Doi: 10.1098/rsta.2014.0182
- May Foundation for Medical Education and Research. (2019). Rubidium RB 82 (intravenös rutt). Återhämtat sig från: mayoclinic.org
- Marques Miguel. (s.F.). Rubidium. Återhämtat sig från: nautilus.Fis.Uc.Pt
- James L. Färga. (12 april 2019). Rubidium. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Doktor. Doug Stewart. (2019). Rubidiumelement fakta. Kemikkolis. Återhämtat sig från: Chemicool.com
- Michael Pilgaard. (10 maj 2017). Rubidium kemiska reaktioner. Återhämtat sig från: pilgaardelegs.com

