Kristalloidlösningar Komposition, typer och exempel
- 2542
- 634
- PhD. Lennart Johansson
De Kristalloidlösningar De är de som bildas genom upplösning av en elektrolyt och andra små vattenlösliga molekyler, som används i kliniska rutinprocedurer såsom justering av vätskevolymen i cirkulationssystemet. I enkla kemiska termer: Dessa lösningar är inget annat än vattenhaltiga och utspädda gruvlösningar.
Kristalloidlösningar spelar en viktig roll i kliniska terapier såsom intravenösa infusioner vätskor för fall av blödning, uttorkning, hypovolemi och infektioner. Vanligtvis är dess saltlösningskoncentration isoton, vilket innebär att antalet upplösta joner är jämförbart med den för blodplasma.
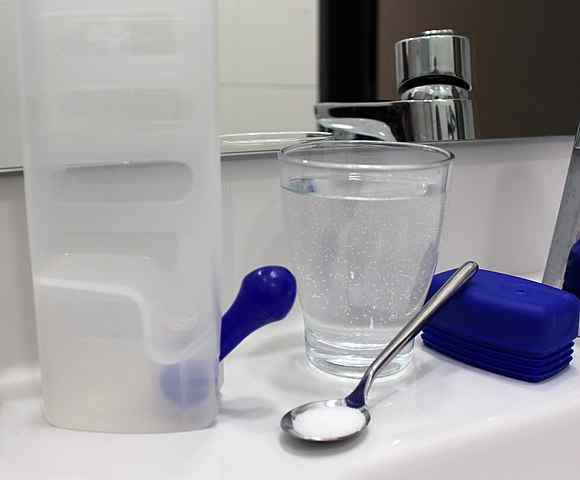
 En kristalloidlösning kan framställas helt enkelt genom att lösa salt och andra lösta ämnen i vatten i en måttlig koncentration. Källa: Rillke/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)
En kristalloidlösning kan framställas helt enkelt genom att lösa salt och andra lösta ämnen i vatten i en måttlig koncentration. Källa: Rillke/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) Kristalloidlösningar orsakar därför inte osmotiska förändringar, utan ger rätt vätska så att blodet fortsätter att bevattna av cirkulationssystemet. På detta sätt uppnås att hjärtat pumpar det utspädda blodet och kan leverera syre till vävnaderna.
Ett exempel på en kristalloidlösning är den normala saltlösningslösningen, som innehåller NaCl i en koncentration av 0,9%. Beroende på det kliniska fallet kan andra lösningar emellertid väljas, med olika komponenter, koncentrationer och typer av tonicitet.
[TOC]
Komposition av kristalloidlösningar
Alla kristalloidlösningar är baserade på steriliserade eller mikroorganismer gratis, så detta är dess favoritlösningsmedel. Annars kunde de inte integrera friska i vår kropp och orsaka någon oönskad reaktion. Som en lösning eller lösning som den är, har den också lösta ämnen, som i huvudsak är mineralsalter eller starka elektrolyter.
Försäljningen kan vara flera, så länge de bidrar i måttliga koncentrationer najonerna+, Växelström2+, K+ och cl-. Förutom oorganiska salter kan de också ha mycket lösliga organiska lösta ämnen i vatten såsom acetater, glukonater och laktater. Några av dessa lösningar innehåller också glukos (dextros).
Kan tjäna dig: hydroxyapatiteKoncentrationerna av dessa salter eller lösta ämnen är mycket varierande och uttrycks antingen i procenttal, milligram av deciliters (Mg/DL), molariteter eller osmolariteter. Valet av det ena eller det andra beror på de kliniska kriterierna.
Grabbar
Det sades i början att kristalloidlösningar ofta används för att tillhandahålla vätskevolym till cirkulationssystemet. Under processen, beroende på dess tonicitet, lider blodplasma eller icke -osmotiska förändringar, som främjar eller gynnar vissa önskade tillstånd hos patienten.
Således är det enda som skiljer en kristalloidlösning från en annan inte den kemiska naturen hos dess lösta ämnen, utan dess tonicitet; det vill säga om det är en hypertonisk, isotonisk eller hypotonisk lösning.
Hypertonisk
En hypertonisk kristalloidlösning är den vars saltlösningskoncentration är överlägsen den som finns i blodplasma. Därför migrerar vatten inifrån cellerna till plasma som har ökat dess tonicitet på grund av närvaron av den hypertoniska kristalloidlösningen. Ett exempel på denna typ av lösning är 3% NaCl, särskilt mer koncentrerad än den 0,9% normala saltlösningen.
Dessa lösningar är kontraindicerade för de flesta kliniska fall, med undantag för de som presenterar neurologiska följder.
Isotonisk
En isotonisk kristalloidlösning är den vars saltlösningskoncentration är jämförbar eller identisk med den för blodplasma och den för den cellulära inre. Därför finns det inget vattenutbyte mellan de två medierna. Ett exempel på denna typ av lösning är 0,9%NaCl, som redan nämnts ovan.
Hypotonisk
Och slutligen är en hypoton kristalloidlösning att vars saltlösning är lägre än för blodplasma och det intracellulära facket eller utrymmet. Den här gången rör sig vattnet in i cellinredningen tills den når balans. Ett exempel på denna typ av lösning är 0,45% NaCl.
Det kan tjäna dig: alkalinoterösa metallerLiksom med hypertoniska kristalloidlösningar är de hypotoniska kontraindicerade för de flesta kliniska fall, särskilt för dem där det finns en risk för cerebralt ödem.
Exempel på kristalloidlösningar
Några exempel på kristalloidlösningar kommer att nämnas och beskrivas nedan. Skillnaden mellan den ena och den andra kommer att ligga i identiteten på dess elektrolyter eller upplösta salter.
Normal saltlösning
Den normala saltlösningen har en 0,9%NaCl -sammansättning, är isotonisk och är också den mest återkommande kristalloidlösningen, eftersom den tjänar till att behandla oändligheter i vanliga uttorkningsfall; till exempel de som orsakas av diarré, chock, kräkningar, blödningar, bland andra. Användning hos patienter med njur- eller hjärtproblem undviks dock.
Laktatlösning
Även känd som Ringer eller Hartmann -lösning (även om de skiljer sig något i sina joniska koncentrationer) är det en som består av en blandning av natriumklorid, natriumlaktat, kalciumklorid och kaliumklorid.
Dess saltlösning är den som liknar den för blodplasma, så den är isotonisk typ. Det används som justeringsvätska eller vätska för fall av brännskador, traumor, elektrolytisk obalans, metabolisk acidos. Det är emellertid kontraindikerat för patienter som lider av hyperkalcemi.
Laktat metaboliseras i vår kropp och hamnar till bikarbonat. Denna lösning kan också innehålla glukonatjon, liksom vissa mängder magnesium, mg2+.
Glukoslösning
Även känd som Dextrose Crystalloid Solution, den finns i två koncentrationer: 5 respektive 10% (D5 eller D10). Detta är initialt hypotoniskt, men det förvandlas till isotonisk när glukos absorberas, vilket ger vatten till njurarna. Även om det ger en betydande mängd kalorier är det kontraindicerat för patienter som lider av hyperglykemi.
Kan tjäna dig: elagsyra: struktur, egenskaper, erhålla, plats, användningarTill skillnad från andra kristalloidlösningar är dessa söta. De sötaste har koncentrationer större än 10% (D20, D30, D50, etc.), Och de är avsedda för patienter med lung- och hjärnödem. Å andra sidan minskar de proteinkatabolism, skyddar levern och hjälper till att bekämpa cirkulationskollapsar.
Hypertoniska och hypotoniska saltlösningar
Hypertoniska saltlösningar (3 och 5% NaCl) används för att leverera vätska till brinnande patienter, inducera hyperosmolaritet och lindra njurens insufficiens. Å andra sidan kontrollerar hypotoniska saltlösningar (0,45% NaCl eller lägre koncentrationer), hypernatremi och är kontraindicerade för att bränna patienter.
Därför tillför den ena effekterna som strider mot den andra; När den hypertoniska lösningen är oumbärlig, avvisas den hypotoniska och vice versa.
Mekanismen bakom alla kristalloidlösningar är baserade på den osmotiska och vattenbalansen mellan intra och extracellulära vätskor.
Referenser
- Lewis sr et al. (3 augusti 2018). Kolloider eller kristalloider för flytande ersättning hos kritiskt människor. Cochrane -samarbetet. Återhämtat sig från: Cochrane.org
- Epstein Em, Waseem M. (29 november 2019). Kristalloidvätskor. I: StatPearls. Treasure Island (FL): StatPearls Publishing 2020 -. Återhämtat sig från: NCBI.Nlm.Nih.Gov
- Wikipedia. (2020). Expander. Hämtad från: i.Wikipedia.org
- Elsevier b.V. (2020). Kristall. Vetenskaplig. Hämtad från: Scientedirect.com
- Sheila Bouie. (2020). Kristalloider: Definition & exempel. Studie. Återhämtat sig från: studie.com

