Mangansulfat (MNSO4) struktur, egenskaper, erhållning, användning

- 3735
- 53
- Johan Johansson
han mangansulfat (ii) Det är ett oorganiskt fast ämne som bildas av manganelementen (MN), svavel (er) och syre (O). Dess kemiska formel är MSO4. Dess vattenfri form (utan vatten i dess struktur) är ett vitt fast ämne. Men det har flera hydratiserade former och alla är rosa fasta ämnen.
Mangansulfat i mycket små (små) mängder används som mikronäringsämne för både djur och människor, eftersom det krävs för organismens normala funktion.
 Mangansulfat Anhidro Mnso4. YOSF0113 på English Wikipedia / Public Domain. Källa: Wikimedia Commons.
Mangansulfat Anhidro Mnso4. YOSF0113 på English Wikipedia / Public Domain. Källa: Wikimedia Commons. Det läggs också till tillsammans med vissa gödselmedel i bristfälliga jordar i mangan (MN) för jordbruksgrödor som behöver det, till exempel druvväxter.
På grund av den rosa färgningen av dess hydratiserade sorter används den i pigment som tjänar till att måla keramik, färgtyger och annat material. Det tjänar också till att få andra manganföreningar.
Mons4 måste manipuleras noggrant. Dess inandning kan orsaka andningsproblem och ge allvarliga besvär i nervsystemet, som inkluderar symtom som liknar Parkinsons sjukdom.
Dess överskott kan också orsaka skador på land och vattenlevande djur och växter.
[TOC]
Strukturera
Vattenfri mangansulfat (utan vatten i dess kristallina struktur) bildas av en manganjon i oxidation +2, det vill säga MN2+ och en sulfatanjon så42-.
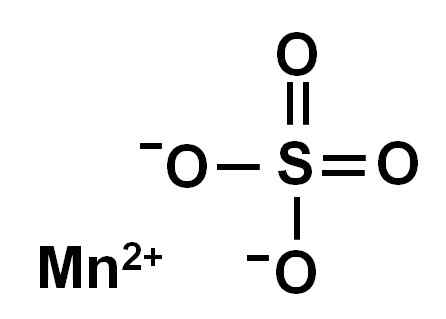 Kemisk struktur av mangansulfat4. Författare: Marilú Stea.
Kemisk struktur av mangansulfat4. Författare: Marilú Stea. Nomenklatur
- Mangansulfat (ii)
- Mangan monosulfat
- Mangansulfat Anhidro Mnso4
- Mangans sulfat MSSO4 •H2ANTINGEN
- Tetrahydrat mangansulfat MSO4 •4 timmar2ANTINGEN
- Mangansulfatpennahydrat4 •5 timmar2ANTINGEN
- Hapthydratiserad mangansulfat4 •7h2ANTINGEN
Egenskaper
Fysiskt tillstånd
Mons4 Vattenfri (utan vatten i dess struktur) är ett kristallint vitt fast ämne. Hydratiserade sorter är dock rosa eller blekröda fasta ämnen.
 Mangansosulfat tetrahydrat mnso4.4 timmar2Eller är en rosa fast. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons.
Mangansosulfat tetrahydrat mnso4.4 timmar2Eller är en rosa fast. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons. Molekylvikt
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Smältpunkt
Vattenfri MSSO4 = 700 ºC
Monohydrat MSO4 •H2O = 400-450 ° C
Menso tetrahydrat4 •4 timmar2O = 30 ° C
Kokpunkt
Vattenfri MSSO4 = Det sönderdelas vid 850 ºC.
Det kan tjäna dig: koboltklorid (COCL2 (: struktur, nomenklatur, egenskaperMenso tetrahydrat4 •4 timmar2O = 850 ° C
Densitet
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Löslighet
Mycket lösligt i vatten: 52 g/100 ml vatten vid 5 ° C. Alkohol. Olöslig i eter. Något lösligt i metanol.
pH
En Monse -lösning4 •H2Eller 5% har ett pH på 3,7.
Kemiska egenskaper
När MNSO4 är uppdelad i dess Mn -joner2+ Och så42-.
Manganjonen (ii) MN2+ I syra eller neutral lösning är den kopplad till 6 vattenmolekyler2Eller bilda den hexaacuomanganiska jonen [Mn (h2ANTINGEN)6]2+, som är rosa.
Den hexaacuomanganiska jonen [Mn (h2ANTINGEN)6]2+ Det är ganska resistent mot oxidation. I basmedium (alkaliskt pH) blir denna jon manganhydroxid (II) Mn (OH)2, som lätt oxideras, bildar manganföreningar (III) och mangan (IV).
 MSSO -lösningar4 Syror är rosa av närvaron av den hexaacuomanganiska jonen [Mn (h2ANTINGEN)6]2+. Författare: Steve Cross. Källa: Pixabay.Mangansulfat har flera hydratiserade former, det vill säga med vatten h2Eller i dess kristallina struktur.
MSSO -lösningar4 Syror är rosa av närvaron av den hexaacuomanganiska jonen [Mn (h2ANTINGEN)6]2+. Författare: Steve Cross. Källa: Pixabay.Mangansulfat har flera hydratiserade former, det vill säga med vatten h2Eller i dess kristallina struktur.
Dessa är monohydrat MSO4 •H2Eller, tetrahydrat mso4 •4 timmar2Eller, Mnse Pentahydrate4 •5 timmar2O och HepThydrate Mso4 •7h2ANTINGEN. Dessa hydratiserade former innehåller den hexaacuomanganesiska jonen [MN (h2ANTINGEN)6]2+ I sina kristaller och av denna anledning är de rosa fasta ämnen.
Monohydratmenso4 •H2Eller det är något avloppsvatten, vilket innebär att det förlorar en del av sitt hydratiseringsvatten långsamt när det utsätts för miljön.
Erhållande
Mons4 kan erhållas genom att behandla manganoxid (ii) MnO, Mn Manghanous Hydroxide (OH)2 o mangankarbonat (ii) MNCO3 Med svavelsyra h2Sw4.
Mnco3 + H2Sw4 → MSSO4 + H2Eller + co2
Ansökningar
Som ett näringskomplement
Mangansulfat i små mängder tjänar vissa funktioner hos människokroppen och djur.
Det är därför det är viktigt som en användbar förening i näring och levereras som ett mattillskott. Det används i spår (extremt små mängder).
Höga mängder kan vara mycket giftiga och skadliga.
I veterinärmedicin
Mons4 Corral fåglar (kycklingar, kalkoner, ankor och phaisanes) administreras för att förhindra bristen eller bristen på manganelement i dessa djur.
Kan tjäna dig: kaliumjodat (kio3)Manganbrist manifesteras till exempel, som sjukdomen kallas Perosis, som är deformationen av benen på unga fågelben.
 Patitos kan kräva Monste -spår4 I sin diet för att förhindra perosis. Författare: s. Hermann & F. Rikter. Källa: Pixabay.
Patitos kan kräva Monste -spår4 I sin diet för att förhindra perosis. Författare: s. Hermann & F. Rikter. Källa: Pixabay. Det gäller för matning av dessa fåglar i mycket små mängder eller spår.
I jordbruket
Mangansulfat används som ett mikronäringsämne i gödselmedel för vinstockar (druvväxter) och tobaksplantager i bristfälliga stegar i mangan.
Vissa studier indikerar emellertid att överskott av mangansulfat kan hämma eller minska bildandet av vissa viktiga enzymer för tillväxt av växter och deras utbrott.
 I vissa fall tillämpar det MNSO4 till marken där druvväxter är. Författare: Schwoaze. Källa: Pixabay.
I vissa fall tillämpar det MNSO4 till marken där druvväxter är. Författare: Schwoaze. Källa: Pixabay. Till exempel har det visat sig att det är giftigt för vissa grödor som bomull.
Mons4 Det har också användning i fungicider och tillsammans med vissa organiska föreningar är en del av vissa bekämpningsmedel.
I flera applikationer
Mons4 Hydratiserad används av dess färg för att förbereda oorganiska pigment som används i röda lack för keramik, i tyger och andra materialfärgämnen.
Mangansulfat används i glasstillverkning och tvålar framställs också med det.
 Vissa keramiska plattor kan innehålla mangansulfatpigment. Författare: Dwilliams. Källa: Pixabay.
Vissa keramiska plattor kan innehålla mangansulfatpigment. Författare: Dwilliams. Källa: Pixabay. Mons4 Det är utgångsmaterialet att få manganmetallen (MN) elektrolytiskt, det vill säga genom att applicera el på vattenhaltiga lösningar.
Det låter dig också få mangansdioxid2 och mangankarbonat3.
Mons4 Det används också för kemisk analys och i formuleringen av lösningar som används i genetikexperiment med mikroorganismer.
Risker
Mangansulfat innehåller manganjonen (ii) (MN2+), som kan vara både ofarlig och giftig beroende på de mängder som personen, djuret eller växten utsätts för.
Mangan är avgörande för den normala funktionen hos organismen hos människor, djur och vissa växter. Men tyvärr är mangan också neurotoxisk, det vill säga det påverkar nervsystemet och vissa växtfunktioner.
Kan tjäna dig: som designade den första moderna termometern?Till synes säkra belopp
Mons4 Administrerad med matformad mat (extremt små eller små mängder) är i allmänhet säker genom mat- och medicineringsadministration, eller FDA (akronym för engelska Food and Drug Administration).
Farliga belopp
Långvarig eller upprepad exponering för denna förening i märkbara mängder kan orsaka skada på människan och djuren.
Det producerar irritation i slemhinnan och slemhinnan i luftvägarna, anorexi, huvudvärk, förlust av balans, lunginflammation och andningsinfektioner.
Kronisk inandning orsakar skador på nervsystemet och genererar manghanism, tremor i de typiska händerna och symtomen på Parkinsons sjukdom.
 Mangansulfat påverkar nervsystemet. Författare: Sabine Zierer. Källa: Pixabay.
Mangansulfat påverkar nervsystemet. Författare: Sabine Zierer. Källa: Pixabay. Därför bör spridningen av MSO -damm undvikas4, Använd andningsutrustning och skyddshandskar.
Det är giftigt för vattenlevande liv och genererar i detta långvariga effekter. Det måste förvaras på platser där det inte finns tillgång till dränering eller avloppssystem. Det är mycket viktigt att inte tillåta det att kasseras i miljön.
Referenser
- ELLER.S. National Library of Medicine. (2019). Sulfatmangan. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. Volym A22. VCH Verlagsgellschaft MBH.
- ELLER.S. National Library of Medicine. (2019). Mangansulfatmonohydrat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Dunham, m.J. (2010). Guide to Yast Genetics: Functional Genomics, Proteomics and Other Systems Analysis. Medelformulering. I metoder i enzymologi. Återhämtat sig från Scientedirect.com.
- Saric, m. och Lucchini, r. (2007). Mangan. Du använder. I handbok om toxikologin för metaller (tredje upplagan). Återhämtat sig från Scientedirect.com.
- Vallero, D. (2014). Neurologiska effekter av luftpolutanter. Mangan. I medel för luftföroreningar (femte upplagan). Återhämtat sig från Scientedirect.com.
- Heja på. (1986). In vitro Kultur av Vitis: Effekterna av ljusspektrum mangansulfat och kaliumjodid på morfogenes. Plant Cell, Tiss och Organ Cult 7: 121-134 (1986). Länk återhämtat sig.Kandare.com.
- « Secbutil struktur, egenskaper, nomenklatur, träning
- +125 Korta och populära ordstäv [med mening] »

