Aluminiumsulfid (Al2S3) -struktur, egenskaper, användningar
- 4635
- 902
- Johan Eriksson
han Aluminiumsulfid (Till2S3) Det är en ljusgrå kemisk förening som bildas av oxidationen av metall aluminium när man förlorar elektronerna i den sista energinivån och blir en katjon, och genom att minska icke -metalliskt svavel, genom att få elektroner överförda genom aluminium och bli en anjon.
För att detta ska hända och aluminium kan ge sina elektroner är det nödvändigt att du presenterar tre hybrid orbitaler SP3, som ger möjligheten att bilda länkar till elektroner från svavel.
Vatten aluminiumsulfidkänslighet innebär att den i närvaro av vattenånga som finns i luften kan reagera och producera aluminiumhydroxid (AL (OH)3), vätesulfid (h2S) och väte (h2) gasform; Om det senare ackumuleras kan orsaka en explosion. Därför bör aluminiumsulfidförpackningar göras med hermetiska behållare.
Å andra sidan, eftersom aluminiumsulfid har reaktivitet med vatten, gör detta det till ett element som inte har något lösningsmedel lösningsmedel.
Kemisk struktur
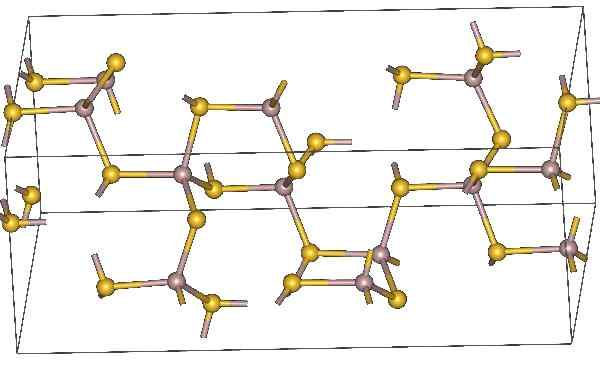
 Kemisk struktur av aluminiumsulfid. Gula atomer representerar svavel. Källa: MaterialScientist, CC BY-SA 3.0, via Wikimedia Commons
Kemisk struktur av aluminiumsulfid. Gula atomer representerar svavel. Källa: MaterialScientist, CC BY-SA 3.0, via Wikimedia Commons Molekylär formel
Till2S3
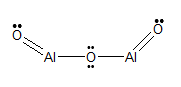
Strukturformel
 Nomenklatur
Nomenklatur
- Aluminiumsulfid.
- Dialuminiumtrisulfid.
- Aluminiumsulfid (III).
- Aluminiumsulfid.
Aluminiumsulfidegenskaper
 Aluminiumsulfidutseende
Aluminiumsulfidutseende Kemiska föreningar uppvisar mestadels två typer av egenskaper: fysiska och kemiska.
Fysikaliska egenskaper
Molmassa
150,158 g/mol
Densitet
2,02 g/ml
Smältpunkt
1100 ° C
Vattenlöslighet
Olöslig
Kemiska egenskaper
En av de viktigaste reaktionerna i aluminiumsulfid är med vatten, såsom substrat eller huvudreaktiva:

I denna reaktion kan bildningen av aluminiumhydroxid och den för vätesulfid observeras om den är i form av gas eller sulfidsyra om den löses i vattnet i form av en lösning. Hans närvaro identifieras av lukten av ruttna ägg.
Kan tjäna dig: kemiska lösningarAnvändning och applikationer
I Super CardPisors
Aluminiumsulfid används vid tillverkning av nano -nätstrukturer som förbättrar den specifika ytarean och elektrisk konduktivitet, så att en hög kapacitans och energitäthet kan uppnås vars tillämpbarhet är den för supercaugades.
Grafenoxid (GO) - Grafen är en av de alotropiska formerna av kol - har fungerat som ett aluminiumsulfidstöd (Al2S3) Med en hierarkisk morfologi som liknar den för Nanorambután tillverkad med den hydrotermiska metoden.
Grafenoxidverkan
Egenskaperna hos grafenoxid som stöd, liksom hög elektrisk konduktivitet och ytarea, gör nanorambutanen2S3 vara elektrokemiskt aktiv.
De specifika CV -kapacitanskurvorna med väldefinierade redoxtoppar bekräftar det pseudokapacitiva beteendet hos nanorambutanen2S3 Hierarkisk, upprätthållen i grafenoxid i NaOH 1M elektrolyt. De specifika CV -kapacitansvärdena som erhållits från kurvorna är: 168,97 vid 5MV/s utforskningshastighet.
Dessutom har en bra galvanostatisk urladdningstid på 903 μs observerats, en stor specifik kapacitans på 2178.16 till strömmen på 3 mA/cm ström2. Energitätheten beräknad från den galvanostatiska urladdningen är 108,91 wh/kg, till den strömtätheten på 3 mA/cm2.
Elektrokemisk impedans bekräftar således den pseudokapacitiva naturen hos den hierarkiska nanorambutanelektroden till2S3. Elektrodstabilitetstestet visar en 57,84 % retention av den specifika kapacitansen på upp till 1000 cykler.
Experimentella resultat tyder på att nanorambutan2S3 Hierarkisk är lämplig för supercaiding -applikationer.
Kan tjäna dig: kromhydroxid: struktur, egenskaper, syntes, användningarI sekundära litiumbatterier
Med avsikt att utveckla ett sekundärt litiumbatteri med hög energitäthet studerades aluminiumsulfid (Al2S3) som aktivt material.
Det första måttet för nedladdningskapacitet2S3 Det var ungefär 1170 mAh g-1 till 100 m g-1. Detta motsvarar 62 % av den teoretiska kapaciteten för sulfid.
AL2S3 Han uppvisade dålig kapacitetsbehållning i det potentiella intervallet mellan 0,01 V och 2,0 V, främst på grund av den strukturella irreversibiliteten i lastprocessen eller extraktionen av LI.
XRD- och K-XES-analys för aluminium och svavel indikerade att ytan på AL2S3 reagerar reversibelt under lastning och lossningsprocesser, medan kärnan i Al2S3 Han visade strukturell irreversibilitet, för lial och li2S bildades av al2S3 I den första nedladdningen och sedan stannade de som de var.
Risker
- I kontakt med vattenfrigörbara gaser som kan brinna spontant.
- Orsaka hudirritation.
- Orsaka svår okulär irritation.
- Kan orsaka andningsirritation.
Information kan variera mellan aviseringar beroende på föroreningar, tillsatser och andra faktorer.
Förfarandet för första hjälpen
Allmän behandling
Leta efter läkarvård om symtomen kvarstår.
Special behandling
Ingen
Viktiga symtom
Ingen
Inandning
Ta offret utanför. Leverera syre om andningen är svår.
Intag
Hantera ett eller två glas vatten och inducera kräkningar. Aldrig framkalla kräkningar eller ge något i munnen till en medvetslös person.
Päls
Tvätta det drabbade området med mjuk tvål och vatten. Ta bort eventuella förorenade kläder.
Ögon
Tvätta ögonen med vatten och blinkar ofta i flera minuter. Ta bort kontaktlinser om du har dem och fortsätt att skölja.
Det kan tjäna dig: Cruise for Crucible: Egenskaper, funktioner, använda exempelBrandbekämpningsåtgärder
Eldfarlighet
Inte brandfarlig.
Utrotningsmedel
Reagera med vatten. Använd inte vatten: använd co₂, sand och dammsläckare.
Stridsförfarande
Använd en autonom andningsapparat med fullständigt skydd. Använd kläder för att undvika kontakt med hud och ögon.
Referenser
- Hälsa och risker.com, (s.f), definition, begrepp och artiklar om hälsa, risker och miljö. Hämtad: Hälsa och risker.com
- Aluminiumsulfid. (s.F). I Wikiwand. Hämtad den 9 mars 2018: Wikiwand.com
- Webbelement.(s.F).Dialuminium trisulpfide, återhämtad den 10 mars 2018: Webelements.com
- LTS Research Laboratories, Inc (2016), Safety Data Sheet Aluminium Sulfide: LTSchem.com

