Trippelpunkt
- 668
- 72
- Prof. Erik Johansson
Vad är trippelpunkten?
han Trippelpunkt Det är en term inom termodynamik som hänvisar till temperaturen och trycket i vilket det samtidigt finns tre faser av ett ämne i ett termodynamiskt jämviktstillstånd. Denna punkt finns för alla ämnen, även om de förhållanden som de uppnås varierar mycket mellan var och en.
En trippelpunkt kan också involvera mer än en fas av samma typ för ett specifikt ämne; det vill säga två olika fasta, flytande eller gasfaser observeras. Helium, särskilt dess Helio-4-isotop, är ett bra exempel på en trippelpunkt som involverar två individuella vätskefaser: normal och överflödig vätska.
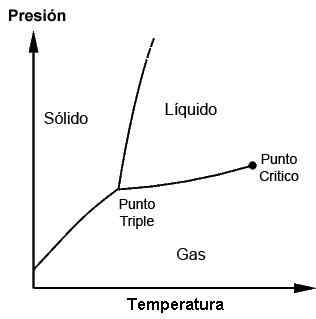
 Fasdiagram som visar trippelpunkten och kritisk punkt
Fasdiagram som visar trippelpunkten och kritisk punkt Vad är det för och när trippelpunkten används?
Triple Point of Water används för att definiera Kelvin, den termodynamiska temperaturbasenheten i International Units System (SI). Detta värde ställs per definition istället för mått.
Trippelpunkterna för varje ämne kan observeras med användning av fasdiagram, som är ritade grafer som tillåter att demonstrera de begränsande förhållandena för de fasta, flytande, gasformiga faserna (och andra, i speciella fall) av ett ämne medan de utövar förändringar i temperatur, tryck och/eller löslighet.
Ett ämne kan hittas i sin smältpunkt där det fasta möter vätskan; Det kan också hittas vid dess kokpunkt där vätskan möter gasen. Det är emellertid vid trippelpunkten där de tre faserna uppnås. Dessa diagram kommer att vara olika för varje ämne, vilket kommer att ses senare.
Kan tjäna dig: API -tyngdkraften: skala och klassificering av råoljaTrippelpunkten kan användas effektivt i kalibreringen av termometrar med trippelpunktceller.
Dessa är prover av ämnen i isolerade förhållanden (inom "celler" av glas) som är vid deras trippelpunkt med kända temperatur- och tryckförhållanden, och därmed underlättar studien av precisionen i termometermätningarna.
Studien av detta koncept i utforskningen av planeten Mars har också använts, där havsnivån försökte under uppdrag som genomfördes på 1970 -talet.
Trippelvatten
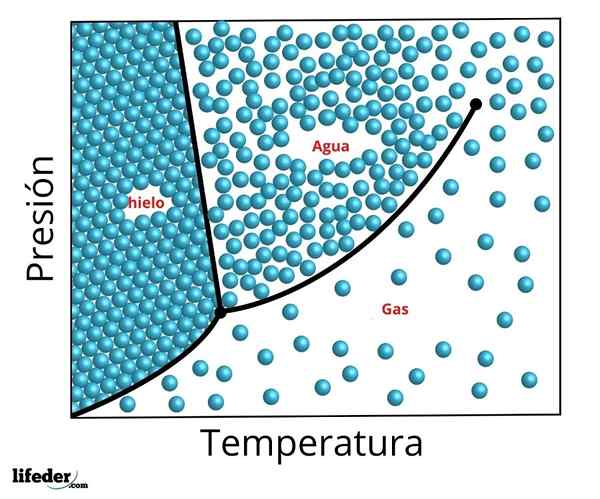 Fasdiagram över trippelpunkten för vatten. Trippelpunkten är den nedre punkten och kritikern den övre punkten
Fasdiagram över trippelpunkten för vatten. Trippelpunkten är den nedre punkten och kritikern den övre punkten De exakta förhållandena för tryck och temperatur vid vilka vatten samexisterar i dess tre faser i jämvikt - flytande vatten, is och ånga - förekommer vid en temperatur av exakt 273,16 K (0,01 ºC) och ett partiellt tryck av ånga 611,656 PASCAL (0,00603659 ATM ).
Vid denna tidpunkt är det möjligt att konvertera ämnet till någon av de tre faserna med minimala förändringar i dess temperatur eller tryck. Även när det totala systemtrycket kan vara beläget över det som krävs för trippelpunkten, om det partiella ångtrycket är på 611 656 PA, kommer systemet att nå trippelpunkten på samma sätt.
Det är möjligt att i den föregående siffran observera representationen av trippelpunkten (eller Trippelpunkt, på engelska) av ett ämne vars diagram liknar vatten, beroende på temperaturen och trycket som krävs för att nå detta värde.
När det gäller vatten motsvarar denna punkt det minsta trycket vid vilket flytande vatten kan existera. För att trycka mindre till denna trippelpunkt (till exempel i ett vakuum) och när en konstant tryckuppvärmning används, konverteras fast is direkt till vattenånga utan att gå igenom vätska; Detta är en process som kallas sublimering.
Det kan tjäna dig: Theory of the Big Bang: Egenskaper, stadier, bevis, problemUtöver detta minsta tryck (PTp), isen kommer först att smälta för att bilda flytande vatten, och bara där kommer den att avdunsta eller koka för att bilda ånga.
För många ämnen är temperaturvärdet vid trippelpunkten den minsta temperaturen vid vilken vätskefasen kan existera, men detta händer inte i fallet med vatten. För vatten inträffar detta inte, eftersom issmältpunkten minskar baserat på trycket, vilket visas med den gröna prickade linjen i den föregående figuren.
I högtrycksfaser har vatten ett ganska komplicerat fasdiagram, som visar femton kända isfaser (vid olika temperaturer och tryck), utöver tio olika trippelpunkter som visas i följande figur:
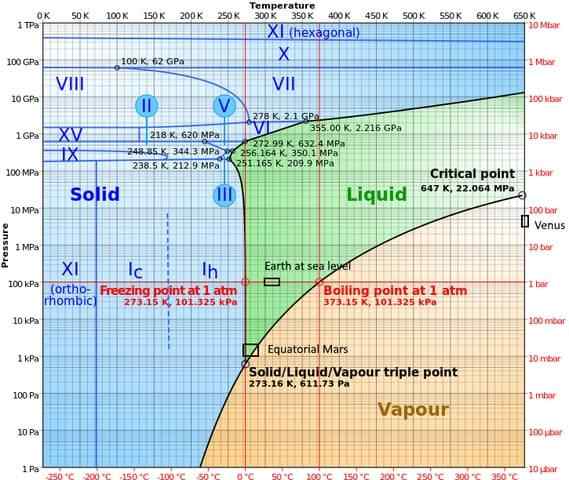
Det kan noteras att is i högtrycksförhållanden kan existera i balans med vätskan; Diagrammet visar att fusionspunkterna ökar med trycket. Vid låga konstant temperaturer och ökande tryck kan ånga omvandlas direkt till is, utan att gå igenom vätskefasen.
De olika förhållandena som förekommer på planeterna där trippelpunkten (land till sjöss och i ekvatorialområdet i Mars) också representeras i detta diagram).
Diagrammet gör det klart att trippelpunkten varierar beroende på platsen på grund av tryck och atmosfärisk temperatur, och inte bara genom experimentell ingripande.
Trippelpunkt av cyklohexan
Cyclohexan är en cyklokan som har molekylformeln för C6H12. Detta ämne har det speciella att ha trippelpunktförhållanden som lätt kan reproduceras, som i fallet med vatten, eftersom denna punkt är belägen vid en temperatur av 279,47 K och ett tryck på 5 388 kPa.
Det kan tjäna dig: levande avgifter: koncept, egenskaper, exempelUnder dessa förhållanden har hirarföreningen, stelnande och smältning med minimala förändringar i temperatur och tryck observerats.
Trippelbensenpunkt
I ett fall som liknar cyklohexan, bensen (organisk förening med kemisk formel C6H6) har lätt reproducerbara trippelpunktförhållanden i ett laboratorium.
Dess värden är 278,5 K och 4,83 kPa, så experiment med denna nybörjarnivå är också vanligt.
Referenser
- Wikipedia. (s.F.). Wikipedia. Erhållen från in.Wikipedia.org
- Britannica, E. (1998). Britannica encyklopedi. Erhållet från Britannica.com
- Power, n. (s.F.). Maktkärnkraft. Erhållet från kärnkraft.netto
- Wagner, w., Saul, A., & Prub, till. (1992). Internationella ekvationer för trycket längs smältningen och längs sublimeringskurvan för vanligt vatten. Bochum.
- Penoncello, s. G., Jacobsen, r. T., & Goodwin, a. R. (nittonhundranittiofem). Till termodynamisk egenskapsformulering för cyklohexan.

