Leverera olika egenskaper, struktur, funktioner
- 5008
- 818
- Per Karlsson
De Dysmutas superoxid (Tråkig) antingen oxidierad superoxid, De utgör en familj av allestädes närvarande enzymer i naturen, vars huvudfunktion består i försvaret av aeroba organismer mot syrefria radikaler, särskilt superoxidanjoniska radikaler.
Reaktionen som dessa enzymer katalyserar förekommer praktiskt taget i alla celler som kan andas (aerobics) och är avgörande för deras överlevnad, eftersom det eliminerar radikal giftig fritt från syre, både i eukaryoter och prokaryoter.
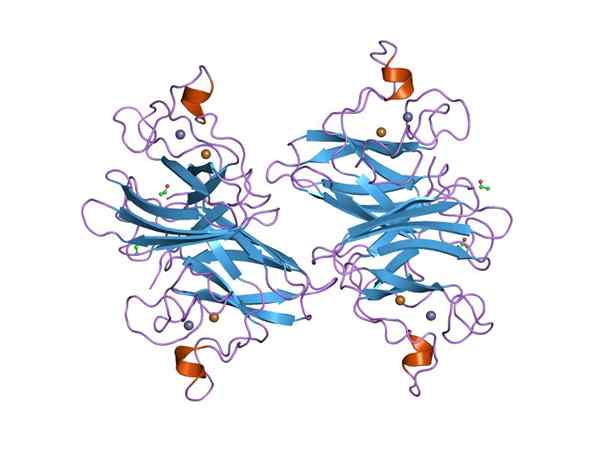
 Graphical representation of a Dymputase superoxide (sod) CU-ZN (Source: Jawahar Swaminathan and MSD Staff at The European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons)
Graphical representation of a Dymputase superoxide (sod) CU-ZN (Source: Jawahar Swaminathan and MSD Staff at The European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) Många sjukdomar hos djur är relaterade till ackumulering av olika reaktiva syrearter, och detsamma gäller för växter, med tanke på att miljön innebär många och konstant typer av oxidativ stress som övervinns tack vare aktiviteten att demontera superoxid.
Denna grupp av enzymer upptäcktes 1969 av McCord och Fridovich och sedan dess har betydande framsteg gjorts angående dessa enzymer och reaktionerna som katalyserar i levande varelser.
[TOC]
Egenskaper
Dysmutas superoxid reagerar med superxidradikaler till verkligt höga hastigheter, vilket innebär en mycket effektiv försvarslinje för att ta bort dessa molekyler.
Hos däggdjur har minst tre isoformer beskrivits för överroxiddysmutas känd som SOD1, SOD2 respektive SOD3.
Två av dessa isoformer har koppar- och zinkatomer i sina katalytiska centra och skiljer sig från varandra när det gäller deras plats: intracellulär (cytosolisk, SOD1 eller Cu/Zn-SOD) eller med extracellulära element (EC-SOD eller SOD3).
SOD2- eller MN-SOD-isoformen, till skillnad från de två föregående, har en manganatom som en kofaktor och dess plats verkar begränsad till mitokondrierna i de aeroba cellerna.
SOD1 -isoenzymer finns främst i cytosol, även om de också har upptäckts i kärnfacket och lysosomer. SOD 3 -isoenzymer har tvärtom beskrivits i blodplasma hos människor, i lymf- och hjärnvätskor.
Kan tjäna dig: hur förändras levande varelser över tiden?Var och en av dessa isoformer kodas av olika gener, men tillhör samma familj och dess transkriptionella reglering kontrolleras i huvudsak av extraintracellulära förhållanden, som utlöser olika interna signalvattenfall.
Annan diskret superoxid
Dysmonisk superoxid med katalytiska platser som har koppar och zink eller manganjoner är inte unika för däggdjur, dessa finns också i andra organismer som inkluderar växter och bakterier i olika klasser.
Det finns en ytterligare grupp dysmutas superoxid, som inte finns hos däggdjur, och som är lätt att känna igen, eftersom de på deras aktiva plats har järn istället för någon av de tre joner som tidigare beskrivits för de andra klasserna av dysmatös superoxid.
I OCH. coli, Overroxiddysmi -i att den innehåller järn är ett perplastiskt enzym som också ansvarar för detektering och eliminering av syre -fria radikaler som genereras under andningen. Detta enzym liknar det som finns i mitokondrierna för många eukaryoter.
Växterna har de tre typerna av enzymer: de som innehåller koppar och zink (Cu/Zn-SOD), som innehåller mangan (MN-SOD) och de som innehåller järn (Fe-SOD) i deras aktiva centrum och i dessa organismer utövar de de analoga funktioner till de av icke-vegetala enzymer.
Reaktion
Dysmy-superoxidenzymsubstrat är superoxidanjoner, som representeras som O2- och som är mellanföreningar i syre reduktionsprocessen.
Reaktionen de katalyserar kan övervägas i allmänna linjer såsom transformation (disputation) av fria radikaler för bildning av molekylärt syre och väteperoxid, som frigörs till miljön eller anställda som ett underlag från andra enzymer, respektive.
Kan tjäna dig: glukaner: struktur, egenskaper och funktionerVäteperoxid kan därefter elimineras från celler tack vare verkan av någon av de peroxidas- och katalasglutationsenzymerna, som också utövar viktiga funktioner i cellskydd.
Strukturera
Dysmutas superoxidisoenzymer hos människor kan skilja sig från varandra när det gäller vissa strukturella aspekter. Till exempel är SOD1 -isoenzymet 32 kDa molekylvikt, medan SOD2 och SOD3 är homotetriker med 95 respektive 135 kDa molekylvikt.
Den andra gruppen av dysmatös superoxid, Fe-SOD som finns i växter och andra organismer än däggdjur, är dimérrica-enzymer av identiska underenheter, det vill säga de är homodimerer.
I vissa växter innehåller dessa Fe-SOD en förmodad N-terminal signalsekvens för transport i det inre av kloroplaster och andra innehåller en triquer-transport C-terminal sekvens till peroxisomer, så det antas att dess subcellulära fördelning är begränsade båda facken.
Molekylstrukturen för de tre typerna av överexamensenzymer konsulteras i huvudsak av alfa-propeller och B-slutade ark.
Funktioner
Dysmonisk superoxid försvarar celler, organ och kroppsvävnader av skador som syrefria radikaler kan orsaka hur lipidperoxidation, protein denaturering och mutagenes av DNA.
Hos djur kan dessa reaktiva arter också orsaka hjärtskador, påskynda åldrande och delta i utvecklingen av inflammatoriska sjukdomar.
Växter kräver också den väsentliga enzymatiska aktiviteten hos överoxiddysmutas, eftersom många stressiga förhållanden i miljön ökar oxidativ stress, det vill säga koncentrationen av skadliga reaktiva arter.
Hos människor och andra däggdjur har de tre isoformerna som beskrivs för överroxiddysmutas olika funktioner. SOD2 -isoenzymet deltar till exempel i celldifferentiering och tumörogenes och även i skydd mot hyperoxiinducerad lungtoxicitet (hög syrekoncentration).
Kan tjäna dig: Inulin: Struktur, egenskaper, mat, kontraindikationerFör vissa arter av patogena bakterier fungerar SOD -enzymer som "virulensfaktorer" som gör att de kan övervinna många oxidativa stressbarriärer som de kan möta under invasionsprocessen.
Relaterade sjukdomar
En minskning av superoxiddysmutasaktivitet kan ges av flera faktorer, både interna och externa. Vissa är relaterade till direkta genetiska defekter i kodande gener för SOD -enzymer, medan andra kan vara indirekt, relaterade till uttrycket av regleringsmolekyler.
Ett stort antal patologiska förhållanden hos människor är relaterade till SOD -enzymer, inklusive fetma, diabetes, cancer och andra.
När det gäller cancer har det fastställts att det finns ett stort antal typer av cancertumörer som har låga nivåer av någon av de tre superoxiden hos däggdjur (SOD1, SOD2 och SOD3).
Oxidativ stress att superoxiddismutasaktivitet förhindrar är också associerad med andra ledpatologier såsom artros, reumatoid artrit. Många av dessa sjukdomar har att göra med uttrycket av faktorer som hämmar SOD-aktivitet, såsom TNF-a-faktor.
Referenser
- Fridovich, jag. (1973). Swiden dysmuta. Annu. Varv. Biokemi., 44, 147-159.
- Johnson, f., & Giulivi, c. (2005). Superoxiddysmuter och IM påverkar människors hälsa. Aspekter av medicinmolekylär, 26, 340-352.
- Oberley, L. W., & Buftner, g. R. (1979). Superoxidens roll i cancer: En översyn. Cancerforskning, 39, 1141-1149.
- Taylor, s., Bowler, c., Läger, w. Van, Montagu, M. Van, Inzé, D., & Rostad, k. (2012). Superoxid som är nedsmusig i växter. Kritiska recensioner inom växtvetenskap, 13(3), 37-41.
- Zelko, jag., Mariani, T., & Folz, r. (2002). Superoxide distam multigenfamilj: i jämförelse av Cuzn-SOD (SOD1), MN-SOD (SOD2) och EC-SOD (SOD3) genstrukturer, evolution och uttryck. Fri radikal biologi och medicin, 33(3), 337-349.
- « Oligosackarides egenskaper, sammansättning, funktioner, typer
- José Rubén Romero biografi, stil, fungerar »

