Aromatiska nukleofila substitutionseffekter, exempel
- 2709
- 256
- PhD. Lennart Johansson
De Aromatisk nukleofil substitution (SNAR) är en reaktion som förekommer i organisk kemi, som består i förskjutningen av en bra utgående grupp av en inkommande nukleofil. Ur sin mekanism och elektroniska aspekter är det det motsatta ansiktet av den aromatiska elektrofila substitutionen (SEAR).
Generellt sett är den utgående gruppen en halogen, som kommer ut som haluro x anjon-. Denna reaktion kan endast äga rum om den aromatiska ringen (mestadels bensen) är bristfällig i elektroner; Det vill säga om du har elektronattraktor Substituent -grupper.
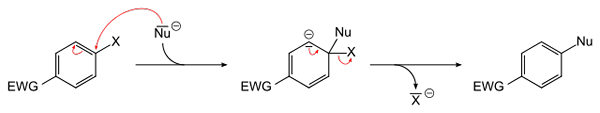
 Allmän ekvation för en aromatisk nukleofil substitution. Källa: Sponk [Public Domain]
Allmän ekvation för en aromatisk nukleofil substitution. Källa: Sponk [Public Domain] Den överlägsna bilden schematiserar vad som sades i föregående stycke. EWG Electron Attractor Group (för sin förkortning på engelska: Elektronuttagningsgrupp), aktiverar den aromatiska ringen för den nukleofila attacken av de negativa Nu -arterna-. Det kan ses att en mellanhand bildas (i mitten), från vilken Haluro X släpps eller släpps-.
Observera att det i enkla X -termer ersätts av Nu i en aromatisk ring. Denna reaktion är mycket mångsidig och nödvändig vid syntesen av nya läkemedel, liksom i studier av syntetisk organisk kemi.
[TOC]
Allmänna funktioner
Den aromatiska ringen kan "laddas" eller "ladda ner" från elektroner beroende på vad deras substituenter är (de som ersätter den ursprungliga C-H-länken).
När dessa substituenter kan donera elektronisk densitet till ringen, sägs det att de berikar den från elektroner; Om de tvärtom är attraherare av elektronisk densitet (EWG som nämns ovan) sägs det då att de fattar elektronringen.
I alla fall aktiveras ringen för en specifik aromatisk reaktion, medan den är inaktiverad för den andra.
Till exempel sägs en aromatisk ring som är rik på elektroner vara aktiv för aromatisk elektrofil substitution; Det vill säga du kan donera dina elektroner till en elektrofilatart och+. Det kommer emellertid inte att donera elektroner till en Nu -art-, Eftersom negativa avgifter skulle avvisa varandra.
Kan tjäna dig: molekylär orbital teoriNu, om ringen är dålig i elektroner, har den inte hur man ger dem till arten och+ (Sear förekommer inte); Istället är det tillgängligheten att acceptera elektronerna från Nu -arterna- (Snar utvecklas).
Skillnader med aromatisk elektrofil substitution
Klargjorde de allmänna aspekterna av inträde, vissa skillnader mellan SNAR och Sear kan nu listas:
- Den aromatiska ringen fungerar som en elektrofil (fattiga elektroner) och attackeras av en nukleofil.
- En utgående grupp X ersätts från ringen; Inte en h+
- Inga Carbocations bildas, men mellanhänder med en negativ laddning som kan flyttas av resonans
- Närvaron av mer attraktiva grupper i ringen påskyndar substitutionen istället för att bromsa den
- Slutligen utövar dessa grupper inte direktörer var (där kol) ersättningen kommer att inträffa. Ersättningen kommer alltid att ske i kol kopplat till den utgående gruppen x.
Den sista punkten illustreras också i bilden: C-X-länken bryts för att bilda den nya C-NU-länken.
Effekter
Av antalet substituenter
Naturligtvis är ju sämre i elektroner ringen, desto snabbare kommer SNAR och minst drastiska att vara de förhållanden som krävs för att det ska inträffa. Tänk på följande exempel representerat i den lägre bilden:
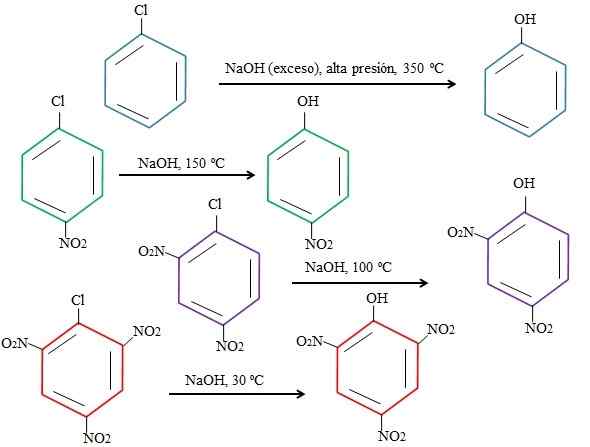 Effekter av substituenter på substitutionerna av 4-nitroklorbensen. Källa: Gabriel Bolívar.
Effekter av substituenter på substitutionerna av 4-nitroklorbensen. Källa: Gabriel Bolívar. Observera att 4-nitroklorbensen (blå ring) kräver drastiska förhållanden (högt tryck och en temperatur på 350 ºC) till ersättningen av CL med. I detta fall är klor den utgående gruppen (CL-) och den nukleofila hydroxiden (OH-).
Det kan tjäna dig: 4 perioder med kemi: från förhistorien fram till idagNär gruppen inte dyker upp2, som är en elektronattraktor (grön ring), kan ersättningen utföras vid en temperatur av 150 ° C vid omgivningstryck. När antalet grupper ökar nej2 Nuvarande (lila och röda ringar), ersättning sker vid allt lägre temperaturer (100 ºC respektive 30 ° C)).
Därför gör grupper inte2 De påskyndar snaren och olikt från elektroner till ringen, vilket gör den mer mottaglig för attacken av OH-.
CL: s relativa positioner kommer inte att förklaras här med avseende på inte2 i 4-nitroklorbensen och hur de förändrar reaktionens hastighet; Till exempel är reaktionshastigheterna för 2-nitroklorbensen och 3-nitroklorbensen olika, den senare är den långsammaste jämfört med de andra isomererna.
Av den utgående gruppen
Återvända till 4-nitroklorbensen är dess substitutionsreaktion långsammare om du jämför den för din fluororerade motsvarighet:
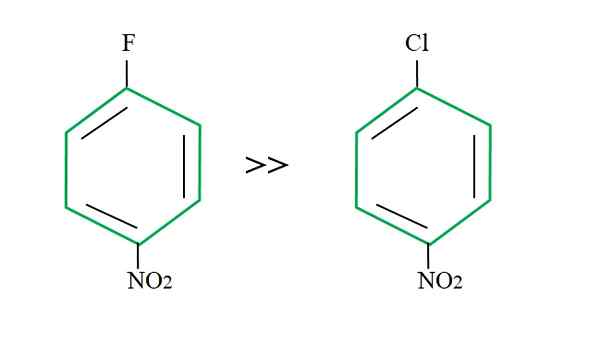 Utgående gruppeffekt på SNAR -reaktioner. Källa: Gabriel Bolívar.
Utgående gruppeffekt på SNAR -reaktioner. Källa: Gabriel Bolívar. Förklaringen av detta kan inte ligga i en annan variabel att skillnaden mellan F och CL. Fluor är en usel utgående grupp, eftersom C-F-länken är svårare att bryta än C-Cl-länken. Därför är uppdelningen av denna länk inte det avgörande steget för hastigheten för SNAR, utan tillägget av Nu- till den aromatiska ringen.
Fluoren för att vara mer elektronegativ än klor, kolatom kopplat till den har större elektronisk brist (CΔ+-FΔ-). Följaktligen är koldioxidlänken mycket mer troligt att attackeras av Nu- än C-Cl-länken. Det är därför ersättningen av F med OH är mycket snabbare än för CL med OH.
Kan tjäna dig: kopparsulfid: struktur, egenskaper, användningarExempel
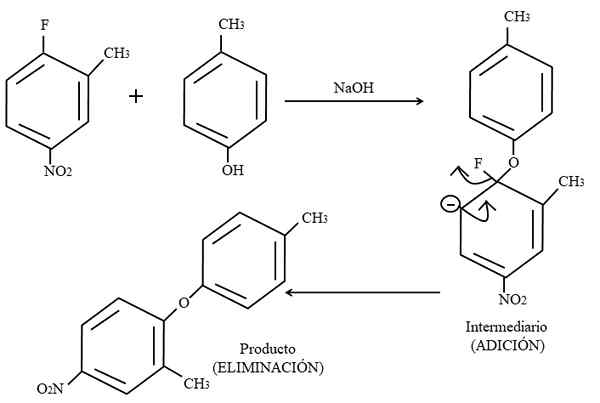 Aromatisk elektrofil byte. Källa: Gabriel Bolívar.
Aromatisk elektrofil byte. Källa: Gabriel Bolívar. Slutligen visas ett exempel på denna typ av organiska reaktioner i den högre bilden nedan. Para-coresol ger inte utseendet på att vara en nukleofil; Men med ett grundläggande medium är dess OH-grupp oskyddad och lämnar en fenoxidanjon, som attackerar 2-metyl-4-nitrofluorzen.
När denna attack inträffar sägs det att nukleofilen läggs till elektrofilen. Detta steg kan ses till höger om bilden, där mellanhandsföreningen med båda substituenter som tillhör ringen bildas.
Genom att lägga till para-coresol verkar en negativ belastning som flyttar resonans inuti ringen (Observera att det upphör att vara aromatiskt).
På bilden visas den senaste resonansstrukturen knappt, från vilken fluoren är klar som f-; Men i verkligheten blir denna negativa belastning otrolig även i gruppens syreatomer2. Efter tillägget av elimineringen, den sista, som är när produkten äntligen bildas.
Slutkommentar
Gruppnr2 återstående kan reduceras till NH -gruppen2, Och därifrån är det möjligt att göra fler syntesreaktioner för att modifiera den slutliga molekylen. Detta visar den syntetiska potentialen för SNAR, och att dess mekanism dessutom består av två steg: ett av tillägg och en av eliminering.
För närvarande finns det emellertid experimentella och beräkningsbevis på att reaktionen i verkligheten följer en samordnad mekanism, där båda stegen förekommer samtidigt genom ett aktiverat komplex och inte en mellanhand.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2019). Nukleofil aromatisk substitution. Hämtad från: i.Wikipedia.org
- James Ashenhurst. (6 september 2019). Nukleofil aromatisk substitution (NAS). Återhämtat från: Masterorganicchemistry.com
- Kemi librettexts. (5 juni 2019). Nukleofil aromatisk substitution. Återhämtad från: kem.Librettexts.org
- « 50 rekommenderade videospelbloggar
- Cirkoniumhistoria, egenskaper, struktur, risker, användningar »

