Tiocyanatbildning, struktur, typer, användningar
- 656
- 82
- Johan Johansson
han Tiocianato Det är en oorganisk anjon vars formel är SCN-. Detta är vad som är känt av pseudohalogenuro, eftersom dess kemiska beteende liknar det hos halogenuros, det vill säga fluorid, klorid, etc. Det är också känt med namnet Rodanida, även om detta för närvarande används mindre ofta.
Tiocianate är en nyfiken art, eftersom det är placerat vid gränsen mellan organisk och oorganisk kemi. Perfekt är det en del av både organiska och oorganiska föreningar, som bara varierar hur det är kopplat eller interaktion. Denna pseudohalogenuro har en stark biokemisk koppling till cyanidjoner och deras metabolism.
 Tiocyanatanjon representerad av en full rymdmodell. Källa: Benjah-Bmm27 / Public Domain.
Tiocyanatanjon representerad av en full rymdmodell. Källa: Benjah-Bmm27 / Public Domain. I den överlägsna bilden finns en representation av SCN- Använda en full rymdmodell. Den gula sfären motsvarar svavelatomen, medan den svarta och blåaktiga är kol- och kväveatomer. Tiocianate har en syresatt bror: Cyanato, OCN-, där svavelatomen ersätts av ett syre.
Kaliumtiocianate, KSCN, är ett av de mest representativa exemplen för denna pseudohalogenuro. Å andra sidan, i organisk kemi finns det tiocianater vars allmänna formler är RSCN, såsom metyltiocianate, CHO3SCN.
[TOC]
Träning
Reaktion mellan cyanid och svavel
SCN -formeln- låter dig skymta att dess syntes är baserad på cyanidreaktionen, CN-, Med en art som donerar svavelatomer. Faktum är att cyanid väl kan reagera med elementärt svavel, s8, eller med tiosulfatanjonerna, s2ANTINGEN32- För att producera tiocyanat:
8 cn- + S8 → 8 SCN-
Cn- + S2ANTINGEN32- → SCN- + S2ANTINGEN32-
Kan tjäna dig: CO2 -länktypDen andra reaktionen katalyseras emellertid av ett enzymsystem som består av sulfurtransferastiosulfat. Vår kropp har dessa enzymer, och därför kan vi metabolisera cyanider som kommer från cyanoglukosider (kolhydrater som har CN -gruppen). På detta sätt blir kroppen av med den skadliga CN-, som stör cellulära andningsprocesser.
Tiocianates upplöstes i saliv och i mindre utsträckning i plasma. Deras koncentrationsnivåer avslöjar hur exponerade är individer för cyanider, antingen på grund av ett överdrivet intag av livsmedel som innehåller det i deras naturliga form (nötter, mandlar, baljväxter, linazas, etc.) eller genom långvarig inandning av röken från cigaretter och tobak.
Tiocian syranutralisering
SCN- Det kan erhållas genom neutralisering av dess sura form: Tiocianic Acid, HSCN eller Isotiocyanic, HNCS. Beroende på basen som används kommer ett tiocianatsalt också att erhållas.
Strukturera
Länkar
 Tiocianate resonansstrukturer. Källa: Ben Mills via Wikipedia.
Tiocianate resonansstrukturer. Källa: Ben Mills via Wikipedia. Den överlägsna bilden visar hur den negativa belastningen på SCN är fördelad-. Observera att alla atomer har SP -hybridisering2, Så de är belägna i samma linje.
Elektronparet kan vara väl beläget på kväveatomen eller på svavelatomen. Detta faktum förklarar en viktig egenskap hos tiocianate: det är en bidentlig ligand, det vill säga kapabel att länka på två olika sätt.
Isomería
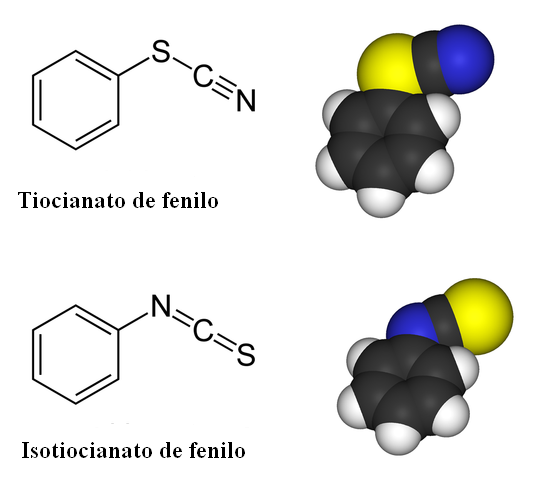
 Samband isomeria för fenyltiocyanat. Källa: Benjah-Bmm27 / Public Domain
Samband isomeria för fenyltiocyanat. Källa: Benjah-Bmm27 / Public Domain I tiocianate -föreningar är länkisomeren närvarande. Som framgår av den överlägsna bilden, SCN- Det kan kopplas till en bensenisk ring eller fenylgrupp antingen med svavelatom eller kväveatom. När det är kopplat till S kallas det tiocianate; Medan när det är kopplat till N, kallas det isotiocianate.
Kan tjäna dig: Stanislao CannizzaroObservera hur -scn eller -ncs ser ut som linjära fragment. Denna linjära geometri förblir oförändrad både i organiska och oorganiska tiocianater.
-CS -bindningen är starkare än -Scn, eftersom kväve, eftersom den är mindre, koncentrerar bättre den negativa belastningen på elektronparet som den kovalenta bindningen kommer att bildas.
Interaktioner
SCN -anjoner- De kan inte interagera med varandra på grund av elektrostatiska avstötningar. Därför behöver de katjoner så att de kan interagera elektrostatiskt och därmed "bygga" en kristall. Oorganiska tiocianater är föreningar i jonisk essens.
Under tiden, för organiska tiocianater, är deras interaktioner baserade på styrkorna från van der Waals; Speciellt de av en dipol-dipolo-typ. SCN -gruppen, antingen som länkad, är polär och bidrar därför till en ökning av föreningens polaritet. Uppenbarligen är dipol-dipolo-interaktioner svagare än joniska attraktioner, närvarande till exempel på KSCN+SCN-).
Organiska tiocianater
Organiska tiocianater är representerade med RSCN -formeln. Å andra sidan har vi också ISOOCIANATES, RNCS med en samband isomeria.
Således räcker det för att ersätta R med alkyl- eller aromatiska molekylfragment för att erhålla flera föreningar. Till exempel Cho3Ch2SCN är etyltiocianate. I föregående avsnitt r6H5SCN eller φ-SCN.
Oorganiska tiocianater
Oorganiska tiocyanater betraktas som salter av tiocianic acid, HSCN, och kan representeras som MSCN, där M är en metallisk katjon eller ammoniumkation. Således har vi till exempel:
-Nascn, natriumtiocyanat
-Nh4SCN, ammoniumtiocianate
Det kan tjäna dig: Skillnader mellan organiska och oorganiska föreningar-Tro (SCN)3, Järntiocyanat
Många oorganiska tiocianater är färglösa fasta salter.
Å andra sidan har vi också tiocianate -komplexen i lösning. Till exempel en vattenlösning som innehåller trosjoner3+ kommer att slutföras med SCN -joner- Att bilda [tro (ncs) (h2ANTINGEN)5]2+, Vilket är blodrött.
På liknande sätt SCN- Det kan komplexa med andra metallkatjoner, till exempel CO2+, Cu2+ och du4+, Varje härstammande ett färgglad komplex.
Ansökningar
SCN -anjonen- Det används för fotometriska metallbestämningar i vattenhaltiga lösningar. Denna metod är baserad exakt på mätningen av absorbansen av de färgglada komplexen av tiocianater med metaller.
Av denna specifika användning är andra lika varierande som de tiocianater som finns.
Organiska tiocianater är avsedda mer än någonting som strukturella block för syntes av svavelföreningar som används i medicin.
Å andra sidan används oorganiska tiocianater som har färgämnen för textilindustrin eller som tillsatser för båtmålningar. Eftersom det är bra SCN -jongivare-, De krävs för produktion av insekticider och fungicider.
Av tiocianaterna är de mest populära NASCN och KSCN, båda mycket begärda inom läkemedel, konstruktioner, elektroniska och agrokemiska industrier.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Tiocyanat. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Tiocyanat. Pubchemdatabas., CID = 9322. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Elsevier b.V. (2020). Tiocyanat. Vetenskaplig. Hämtad från: Scientedirect.com
- Nouryon. (2020). Tiocyanat. Hämtad från: Sulfurderivatives.Nouryon.com
- Riedel, k., Hagundan, h.W. Och Scherer, g. (2013). Tiocyanat i plasma och saliv [BioMonitoring Methods, 2013]. I MAK - Collection for Occupational Health and Safety (eds och). Doi: 10.1002/3527600418.BI5712SALE0013
- « Journalistiska texter Egenskaper, struktur, typer, exempel
- Specialiserade texter Egenskaper, struktur, typer, exempel »

