Kolatom
- 1472
- 89
- Johan Johansson
Vi förklarar vad som är kolatomen, dess elektroniska struktur, egenskaper och omloppshybridisering.
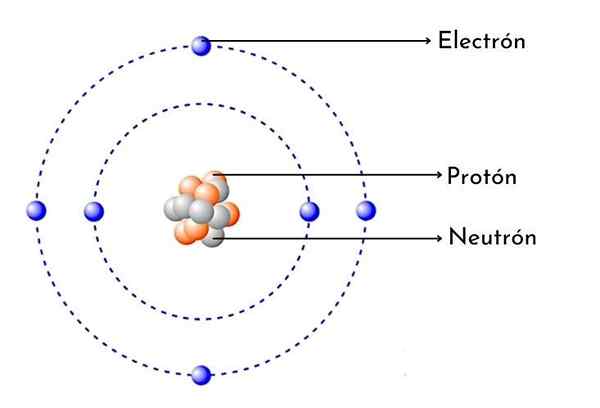
 Kolatomschema
Kolatomschema Vad är kolatom?
Kol är elementnummer 6 i den periodiska tabellen och är ett av de viktigaste elementen som finns. Dess betydelse uppstår från en mycket rik och varierad kemi som gör att detta element bildar Livsbas på planeten jorden, som vi vet.
Det handlar om en icke-metall tillhör Grupp 14 i det periodiska tabellen (tidigare grupp 4A) och den andra perioden. I sin naturliga form är den förknippad med kol (både mineral och grönsak) och sot, där det främst är i form av grafit eller annan alotrope.
han Kolatom Det är bland de minsta av det periodiska tabellen. Det är en tetravalent atom, det vill säga det kan bildas upp till fyra länkar med andra atomer lika eller skiljer sig från samma.
Kol är av stor betydelse för människor. Det är en av huvudkomponenterna i vår kropp och bildar mer än 19% av dess massa. Dessutom har den också flera tekniska tillämpningar härrörande från dess atomegenskaper.
Egenskaper hos kolatomen
- Kolatomen är en icke -metall: Kol är ett icke -metalliskt element som kan kombineras med många andra element i det periodiska tabellen. Kolatomer kan förvärva eller ge elektroner till andra atomer och bli anjoner respektive katjoner.
- Den har 6 protoner i sin kärna: Atomantalet kol är 6, vilket innebär att det har 6 protoner i sin kärna. Det betyder också att en neutral kolatom har 6 elektroner runt kärnan.
Kan tjäna dig: magnetisk separering- Det tillhör block P i det periodiska tabellen: Den elektroniska kolkonfigurationen i dess grundläggande tillstånd är 1s2 2s2 2 p2. Som framgår är de sista Valencia -elektronerna belägna i P -orbitaler, så kolet tillhör block P i det periodiska bordet.
- Valensen för kolatomen är +2, +4 och -4: Kolvalensskiktet saknas endast 4 elektroner för att fylla helt och därmed förvärva den elektroniska konfigurationen av ädla neongas. Av denna anledning kan kol bilda karbidjonen, c4-, som har 4 elektroner mer än neutralt kol. Å andra sidan kan kolatomen också förlora de två 2P -elektronerna och därmed bli kolkatjonen (C2+), eller alla fyra elektroner i Valencia, blir den kolhaltiga katjonen (c4+).
- Du kan bilda flera alotroper: Elementärt kol finns i två vanliga naturliga former som är grafit och diamant, som har radikalt motsatta egenskaper. Dessutom kan du bilda olika killar, kol- och grafen -nanorör.
De tre isotoperna i kolatomen
Alla kolatomer har sex protoner i kärnan, men inte alla har samma antal neutroner, vilket ger upphov till tre isotoper:
- Kol-12 (12C): Det är den mest stabila och rikliga (cirka 98,9%). Den har 6 neutroner i sin kärna.
- Kol-13 (13C): Den har 7 neutroner.
- Kol-14 (14C): Det är radioaktiva ys e -användningar för datum för gamla objekt.
Elektronisk struktur i kolatomen
Liksom varje kolatom har den sex positiva protoner i sin kärna, då har den också 6 elektroner med negativ belastning som vänder.
Kan tjäna dig: alikvot (kemi)Det sätt på vilket dessa elektroner distribueras eller den elektroniska konfigurationen av kolatomen är:
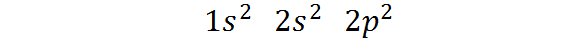
Denna elektroniska konfiguration indikerar det Kol har 2 elektroner i 1S -orbital, Två elektroner i orbital 2s, och två elektroner fördelade mellan de tre orbitalerna 2p.
Å andra sidan är Valencia -lagret för kol varvet. Som vi ser har kol totalt 4 elektroner på nivå 2, Så vi säger det Den har fyra Valencia -elektroner.
Detta är anledningen till att kolet finns där det tidigare kallades grupp 4a i det periodiska tabellen.
Atomisk orbital hybridisering i kolatomen
Atomer reagerar och länkar till varandra genom sina valenselektroner och de orbitaler de upptar. Det senare har emellertid inte alltid tillräcklig orientering för att bilda nödvändiga länkar.
Valencias länkteori säger att atomer blandar sina atomorbitaler för att bilda nya hybrid orbitaler som har korrekt vägledning. Denna process kallas hybridisering.
Beroende på antalet atomer som en kolatom är kopplad kommer den att blanda eller hybridisera ett annat antal rena atomorbitaler. Detta ger upphov till Tre olika hybridiseringar, Vad är dem:
Sp
Inträffar när kol är kopplat till Två atomer. I detta fall blandas omloppet med en av de tre P -orbitalerna, vilket ger upphov till två SP -orbitaler som pekar i motsatta riktningar (180º från varandra).
Kan tjäna dig: Mercury BarometerDe två P -orbitalerna som finns kvar utan blandning används för att bilda PI -bindningar. Kolatom kan bildas En trippellänk (som innehåller två PI -bindningar) med en enda atom eller kan bildas Två dubbla länkar, en med varje atom (och med en länk pi vardera).
Sp2
När kol vill gå med Tre atomer, Du behöver tre hybrid orbitaler, så blanda tre rena orbitaler: orbitalen och två orbitaler p. Detta genererar tre SP -hybrid orbitaler2 Den punkten till hörnen på en liksidig triangel.
Orbital P som inte användes kan bilda en PI -länk till någon av de tre länkade atomerna, vilket ger upphov till en dubbelbindning.
Sp3
När kol kommer att länka till Fyra atomer, Blanda de fyra rena orbitalerna i ditt valenslager för att generera 4 hybrid orbital sp3. Dessa pekar på topparna i en vanlig tetrahedron.
Eftersom det inte finns några orbitaler för att bilda PI -bindningar, ett kol med SP -hybridisering3 Du kan bara bilda fyra enkla länkar och ingen flera länk.
Referenser
- Britannica, redaktörerna för Encyclopaedia. Kol - fakta, användningar och egenskaper. Hämtad från https: // www.Brittisk.com/science/con-kemisk element
- Global övervakningslaboratorium. (s. F.). Kolcykel växthusgaser. Hämtad från https: // gml.Noaa.Gov/ccg/isotopes/kemi.Html

