Kalciumoxid (CAO)
- 2819
- 611
- Johan Johansson
Vad är kalciumoxid?
han kalciumoxid (CAO) är en oorganisk förening som innehåller kalcium och syre i jonformer (för att inte förvirra med kalciumperoxid, CAO2). Världsligt känd som kalk, ett ord som utser varje oorganisk förening som innehåller karbonater, oxider och kalciumhydroxider, utöver andra metaller som kisel, aluminium och järn.
Till denna oxid (eller kalk) hänvisar också till exempel levande eller kalk, beroende på om den är hydratiserad eller inte. Levande kalk är kalciumoxid, medan kalk är dess hydroxid. I sin tur är kalksten (lime eller härdad kalk) faktiskt en sedimentär berg som huvudsakligen består av kalciumkarbonat (Caco3).
Det är en av de största naturliga källorna till kalcium och utgör råmaterialet för produktion av kalciumoxid. Hur produceras denna oxid? Karbonater är mottagliga för termisk sönderdelning; Uppvärmning av kalciumkarbonater vid temperaturer större än 825 ºC, leder till limebildning och koldioxid.
Det föregående uttalandet kan beskrivas på följande sätt: Caco3(S) → CAO (S) + Co2(g). Eftersom jordskorpan är rik på kalksten och kalcit, och i haven och stränderna är havsskal (råvaror för produktion av kalciumoxid) riklig, kalciumoxiden en relativt billig reagens.
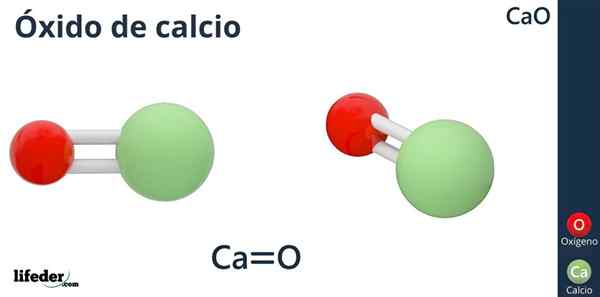
Formel
Den kemiska formeln för kalciumoxid är CAO, där kalcium är som syrjonen (elektronacceptor) CA2+, och syre såsom basjonen (elektrondonator) eller2--.
Varför har kalcium en laddning +2? Eftersom kalcium tillhör grupp 2 i den periodiska tabellen (SR. Scholambara), och har bara två valenselektroner tillgängliga för länkbildning, vilket ger syreatomen.
Kan tjäna dig: kaliumoxid (K2O)Kalciumoxidstruktur
 Kristallin struktur av kalciumoxid
Kristallin struktur av kalciumoxid Den kristallina strukturen (pärla salttyp) för kalciumoxid representeras i den övre bilden. Voluminösa röda sfärer motsvarar Ca -joner2+ och vita sfärer till joner eller2-.
I detta kubiska kristallina arrangemang varje jon CA2+ är omgiven av sex joner eller2-, Ockcloured i de oktaedriska hålen som lämnats av stora joner bland dem.
Denna struktur uttrycker maximalt den joniska karaktären hos denna oxid, även om den anmärkningsvärda skillnaden i radioapparater (den röda sfären är större än vit) ger den en svagare kristallin retikulär energi om det jämförs med Mgo.
Kalciumoxidegenskaper
 Kalciumoxidutseende
Kalciumoxidutseende Fysiskt är det ett kristallint vitt fast ämne, toalett och med starka elektrostatiska interaktioner, som är ansvariga för deras höga fusionspunkter (2572 ºC) och kokning (2850 ºC). Dessutom har den en molekylvikt på 55 958 g/mol och den intressanta egenskapen att vara termoluminescerande.
Detta innebär att en bit kalciumoxid som utsätts för en låga kan lysa med intensivt vitt ljus, känt på engelska med namnet Rampljus, eller på spanska, kalciumljus. Jonerna Ca2+, I kontakt med eld har de sitt ursprung en rödaktig låga, vilket kan ses i följande bild.
 Kalciumljus eller rampljus
Kalciumljus eller rampljus Löslighet
Cao är en grundläggande oxid som har en stark affinitet för vatten, i en sådan grad som absorberar fukt (det är ett hygroskopiskt fast ämne), som reagerar omedelbart för att producera avstängt eller kalciumhydroxid:
Cao (s) + h2Eller (l) => ca (OH)2(S)
Denna reaktion är exoterm (den ger upp värme) på grund av bildandet av ett fast ämne med starkare interaktioner och ett mer stabilt kristallint nätverk. Reaktionen är dock reversibel om Ca (OH) värms upp2, uttorkning och belysning av kalk; Sedan, lime "återfödd".
Kan tjäna dig: Safranine: Egenskaper, användning, tekniker, toxicitetDen resulterande lösningen är mycket grundläggande, och om den är mättad med kalciumoxid når den ett pH på 12,8.
Likaså är det lösligt i glycerol och i syra- och sockerhaltiga lösningar. Som en grundläggande oxid har den naturligtvis effektiva interaktioner med sura oxider (SIO2, Till2ANTINGEN3 och tro2ANTINGEN3, till exempel) att vara löslig i de flytande faserna av dem. Å andra sidan är det olösligt i ekologiska alkoholer och lösningsmedel.
Användning/applikationer
CAO har en enorm otalig industriell användning, liksom i acetylensyntes (CH≡CH), vid extraktion av avloppsfosfater och i reaktionen med svaveldioxiden av läskedrycker.
Andra användningar av kalciumoxid beskrivs nedan:
Som murbruk
Om kalciumoxid blandas med sand (SIO2) och vatten, kakor med sanden och reagerar långsamt med vattnet för att bilda tråkig kalk. I sin tur, CO2 Från luften upplöses i vattnet och reagerar med saltet för att bilda kalciumkarbonat:
Ca (oh)2(s) + co2(g) => caco3(s) + h2Eller (l)
Caco3 Det är en mer resistent och hård förening än CAO, vilket får murbruk (föregående blandning) att härda och fixa tegelstenar, block eller keramik mellan dem eller till önskad yta.
I glasproduktion
Det väsentliga råmaterialet för glasproduktion är kiseloxider, som är blandade med kalk, natriumkarbonat (NA2Co3) och andra tillsatser och utsattes sedan för uppvärmning, vilket resulterar i ett glasartat fast ämne. Detta fasta ämnet värms därefter och blåst i alla siffror.
I gruvdrift
Den tråkiga kalken upptar en större volym än den levande kalk på grund av interaktioner med vätebroar (O-H-O). Den här egenskapen utnyttjas för att bryta klipporna från dess uppfattning.
Kan tjäna dig: katalytisk hydreringDetta uppnås genom att fylla dem med en kompakt blandning av kalk och vatten, som är förseglad för att fokusera sin värme och expansiva kraft i berget.
Som silikatens borttagningsmedel
Cao smälter samman med silikaterna för att bilda en koalescent vätska, som sedan extraheras från råmaterialet från en viss produkt.
Till exempel är järnmineraler råmaterialet för produktion av metalliskt järn och stål. Dessa mineraler innehåller silikater, som är oönskade föroreningar för processen och elimineras med den nyligen beskrivna metoden.
Kalciumoxid nanopartiklar
Kalciumoxid kan syntetiseras som nanopartiklar, varierande kalciumnitratkoncentrationer (CA (NO3)2) och natriumhydroxid (NaOH) i lösning.
Dessa partiklar är sfäriska, grundläggande (liksom den fasta till makroskalan) och har mycket ytarea. Följaktligen gynnar dessa egenskaper katalytiska processer. Som? Undersökningar svarar för närvarande på den frågan.
Dessa nanopartiklar har använts för att syntetisera substituerade organiska föreningar - som härrör från pyridin - i formuleringen av nya läkemedel för att utföra kemiska transformationer såsom konstgjord fotosyntes, för rening av vatten från tunga och skadliga metaller och som fotokatalytiska medel.
Nanopartiklar kan syntetiseras på biologiskt stöd, såsom papaya och grönt teblad, för att ge dem användning som ett antibakteriellt medel.
Referenser
- Scifun.org. (2018). Kalk: kalciumoxid. Återhämtat sig från: scifun.org.
- Wikipedia. (2018). Kalciumoxid. Hämtad från: i.Wikipedia.org
- Pub. (2018). Kalciumoxid. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Shiver & Atkins. (2008). Oorganisk kemi. I Elementen i grupp 2. (fjärde upplagan., p. 280). MC Graw Hill.