Icke -metalloxider

- 3579
- 339
- Hans Olsson
 Koldioxid är en växthusgas och är också en icke -metallisk oxid
Koldioxid är en växthusgas och är också en icke -metallisk oxid Vad är icke -metalliska oxider?
De icke -metalloxider De är binära föreningar som bildas mellan en icke -metall med positivt oxidationstillstånd och syre med oxidationstillstånd -2. Även kallade anhydrider och syraoxider tenderar dessa föreningar att bilda syralösningar genom att lösa dem i vatten och tenderar också att reagera med basiska oxider för att bilda oxisalsalter.
Icke -metalliska oxider är mycket vanliga. Faktum är att de är överallt. Vatten, den vitala vätskan som täcker två tredjedelar av jordens yta, är en icke -metallisk oxid. Så är koldioxid som vi andas ut under våra andnings- och svaveloxider som förorenar luft och som orsakar surt regn.
Som bildas av icke -metaller och syre (som också är en icke -metall), länkar som förenar deras atomer är kovalenta bindningar, i de flesta polära fall. Av denna anledning har den stora majoriteten av icke -metalliska eller anhydridoxider betydligt låga kokpunkter, och många av dem är gaser vid rumstemperatur.
Icke -metalliska oxideregenskaper
- De har ingen lyster eller metallisk glans.
- De kan ha olika färger.
- Deras atomer är förenade med kovalenta bindningar istället för joniska länkar.
- De bildas av syre och en icke -metall.
- Jämfört med metalloxider har de vanligtvis låga smält- och kokpunkter, även om de är mycket olika.
- De flesta är gaser, men kan också hittas i fast tillstånd (som N2ANTINGEN3) eller vätska vid rumstemperatur.
- Fasta icke -metalliska oxider är vanligtvis spröda och kan ha olika hårdhet.
- De är dåliga ledare av värme och el.
- När de löser dem i vatten reagerar de för att bilda oxacidsyror.
- Några av dess oxacidsyror är starka syror som tenderar att bilda anjoner eller oxyanioner i vattenlösning.
- De reagerar med grundläggande oxider för att bilda oxisala salter.
Typer av icke -metalliska oxider
Det finns ingen formell eller allmänt accepterad klassificering av icke -metalliska oxider. Dessa kan emellertid grupperas enligt deras syrabasegenskaper.
Även om icke -metalliska oxider också kallas syraoxider, reagerar inte alla alltid som syror mot andra föreningar. Med tanke på detta kan tre olika typer av icke -metalliska oxider identifieras enligt deras syra/basegenskaper:
Icke -metallsyraoxider
De är de vanligaste. Den stora majoriteten av föreningarna mellan syre och en annan icke -metall, oavsett deras oxidationsstatus, producerar mineralsyror när de löser dem i vatten, vilket ger upphov till syralösningar.
- Några exempel på sura oxider är kväve -anhydrid (n2ANTINGEN5) och svavelsyraanhydriden (så3).
Neutrala icke -metalliska oxider
Vissa icke -metalliska oxider reagerar inte med vatten alls när de löses i det. I dessa fall är den resulterande lösningen neutral (den är varken sur eller grundläggande).
- Några exempel på neutrala oxider är kolmonoxid (CO), kväveoxid (N₂O) och klordioxid (CLO2).
Icke -metalliska amfotoriska oxider
Termen Anfótero Det hänvisar till förmågan hos en kemisk förening att bete sig som en syra eller som bas, beroende på vem som reagerar på. Det vill säga det här är föreningar som är både syror och baser samtidigt.
- Bland de amfotiska icke -metalliska oxiderna är det vanligaste vatten (h2ANTINGEN). Vattnet är amfotent, eftersom det kan ge en proton till en bas (fungerar som en syra), men det kan också få en proton av en syra (fungerar som bas).
Exempel på icke -metalliska oxider
De vanligaste icke -metalliska oxiderna för varje icke -metall presenteras nedan, tillsammans med dess molekylformel, dess namn enligt den systematiska nomenklaturen för IUPAC, enligt lager nomenklaturen och enligt den traditionella nomenklaturen:
Koloxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
Co | Kolmonoxid | Koloxid (ii) | Kolhaltig anhydrid |
CO2 | Koldioxid | Koloxid (IV) | Karbonhydrid |
Kväveoxider
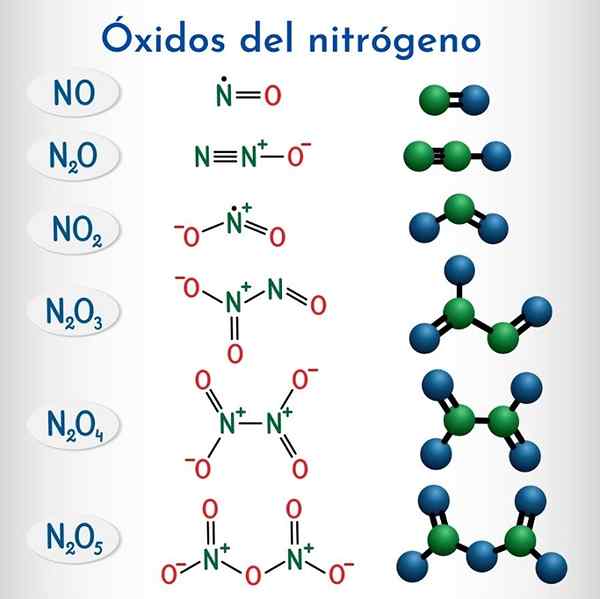 Formler och strukturer för de 6 icke -metalliska kväveoxiderna
Formler och strukturer för de 6 icke -metalliska kväveoxiderna Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
N2o | Dinitrogenmonoxid | Kväveoxid (I) | Kväveoxid (Hiponitroso Anhydride) |
NEJ | Kväve -monoxid | Kväveoxid (II) | Kväveoxid |
N2o3 | Dinitrogentrioxid | Kväveoxid (III) | Kväveanhydrid |
N2o4 | Dinitrogentetraxid | Kväveoxid (IV) | Kväve -tetraxid |
No2 | Kvävedioxid | Kväveoxid (IV) | Kvävedioxid |
N2o5 | Dinitrogenpenoxid | Kväveoxid (V) | Kväveanhydrid |
Fosforoxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
P2o3 | Diftosfacking trioxid | Fosforoxid (III) | Fosforhydrid |
P2o5 | Difosfackpentaoxid | Fosforoxid (V) | Fosforhydrid |
P2o4 | Diftosfack tetraxid | Fosforoxid (III, V) | --- |
Arsenikoxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
As2o3 | Dirsenen trioxid | Arsenikoxid (III) | Arsenioso -anhydrid |
As2o5 | Diarenpenten | Arsenikoxid (V) | Arsenhydrid |
Antimonoxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
SB2O3 | Trioxid | Antimonoxid (III) | Antimonisk anhydrid |
Sb2o5 | Pentsimid | Antimonoxid (V) | Antimonhydrid |
Svaveloxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
Sw | Svavelmonoxid | Svaveloxid (II) | Hyposulfuroaktig anhydrid |
SO2 | Svaveldioxid | Svaveloxid (IV) | Svaveldydrid |
So3 | Svaveltrioxid | Svaveloxid (VI) | Svavelydrid |
Selenoxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
SEO | Selenmonoxid | Selenoxid (ii) | Hypiplolenös anhydrid |
Seo2 | Selendioxid | Selenoxid (IV) | Selenanhydrid |
Seo3 | Selentrioxid | Selenoxid (VI) | Selénisk vattenhydrid |
Teluriooxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
Teo | Teluriomonoxid | Telurio Oxide (II) | Hypeluro- anhydrid |
Teo2 | Teluriodioxid | Teluriooxid (IV) | Teluro- anhydrid |
Teo3 | Telurio trioxid | Teluriooxid (VI) | Tellurisk anhydrid |
Kloroxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
Kl2 | Klormonoxid | Kloroxid (I) | Hypoklorös anhydrid |
Cl2o3 | Klortrioxid | Kloroxid (III) | Kloranhydrid |
Cl2o5 | Klorpenoxid | Kloroxid (V) | Kloralydrid |
Cl2o7 | Klorheptoxid | Kloroxid (VII) | Perklorantid |
Bromoxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
Br2o | Brommonoxid | Bromoxid (i) | Hipobromous anhydrid |
Br2o3 | Bromintrioxid | Bromoxid (III) | Bromig anhydrid |
Br2o5 | Bromspentaoxid | Bromoxid (V) | Bromartydrid |
Br2o7 | Brom heptaoxid | Bromoxid (VII) | Perhydrid |
Jodoxider
Formel | IUPAC Systematic Name | Beståndsnomenklatur | Traditionell namn |
I2o | Jodmonoxid | Jodoxid (i) | Hypoyodosoanhydrid |
I2o3 | Jodtrioxid | Jodoxid (III) | Yodosoanhydrid |
I2o5 | Jodpenoxid | Jodoxid (V) | Yodiumantydrid |
I2o7 | Jodheptoxid | Jodoxid (VII) | Periódikoisk anhydrid |

