Elektronisk affinitet

- 3993
- 325
- Johan Eriksson
Vad är elektronisk affinitet?
De Elektronisk affinitet Det definieras som mängden energi som frigörs när en mol av atomer i gasformigt tillstånd kombineras med en mol av elektroner för att bilda en mol av anjoner, också i ett gasformigt tillstånd. Med andra ord hänvisar det till det negativa av entalpivariationen i följande process:
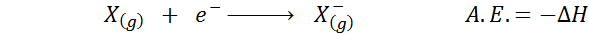
Som namnet antyder, elektronisk affinitet (a.OCH.) Det är ett mått på trenden som har en atom att gå med i en elektron. Det vill säga den mäter affiniteten hos en atom för elektroner.
Tolkning av elektronisk affinitet
På grund av hur det definieras innebär en hög elektronisk affinitet att entalpivariation är mycket negativ. Detta indikerar i sin tur att processen är energiskt gynnsam och att produkterna är mer stabila än reagensen. Av denna anledning kan vi också säga att elektronisk affinitet är ett indirekt mått på stabiliteten hos en anjon.
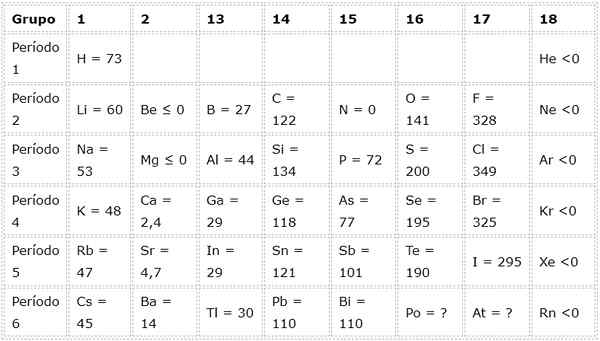
Ju större den elektroniska affiniteten hos en atom, desto större är trenden att bilda anjonen. Det är därför atomer som klor, vars elektroniska affinitet är 349 kJ/mol, tenderar att bilda anjoner enkelt (i detta fall kloridanjon), medan andra atomer som magnesium, vars elektroniska affinitet är negativa, inte bildar anjoner.
Förtydligande av elektronisk affinitet och joniseringsenergi
Många gånger tänker du på elektronisk affinitet som motsatsen till joniseringsenergi (tendensen för en gasformig atom att förlora en elektron), men detta är inte så. Tänk till exempel en atom x.
Det kan tjäna dig: Tusfrano: kemisk struktur, egenskaper och användningarDess elektroniska affinitet avser förändringen av energin i processen som visas ovan i den första ekvationen. Emellertid hänvisar dess joniseringsenergi till förändringen av energi när atomen tappar en elektron:
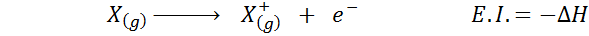
Även om denna reaktion verkar vara den motsatta reaktionen på den föregående.
Vad bestämmer elektronisk affinitet?
För att veta vilka egenskaper hos en atom som påverkar värdet på dess elektroniska affinitet måste stabiliteten hos den ursprungliga atomen övervägas, liksom den för den anjon som bildas. Om anjonen är mer stabil än atomen, kommer den elektroniska affiniteten att vara hög, annars blir den låg eller till och med negativ.
Men hur man vet vilken av de två arterna som är mer stabila? För det förlitar vi oss på två faktorer:
- Elektronisk konfiguration. Det finns mer stabila elektroniska inställningar än andra. I allmänhet är hela lagerkonfigurationen (som ädla gaser) den mest stabila av alla. Sedan följs det av semi-llena-lagarkonfigurationen, där alla orbitaler i Valencia-skiktet har hälften av de elektroner de kunde ha (till exempel 4S14p3).
- Elektronisk avstötning. Om en lastanjon -1 jämförs, med en lastanjon -2, kommer det i det andra fallet att bli mycket mer avvisande mellan elektroner, som destabiliserar anjon.
Periodisk elektronisk affinitetstendens
 Graf som visar de elektroniska affiniteterna i de första 9 elementen i det periodiska tabellen
Graf som visar de elektroniska affiniteterna i de första 9 elementen i det periodiska tabellen Elektronisk affinitet är en av de periodiska egenskaperna hos elementen. Det vill säga, det är en egenskap som varierar förutsägbart från ett element till ett annat beroende på dess position i det periodiska tabellen. I allmänna termer ökar elektronisk affinitet när atomstorleken minskar.
Det kan tjäna dig: semi -utvecklad formel: vad är och exempel (metan, propan, butan ...)I detta avseende varierar storleken på atomerna beroende på perioden och gruppen där den är belägen, så dess elektroniska affinitet varierar också som förklaras nedan:
Variation av elektronisk affinitet under en period
Åtminstone för de representativa elementen (de som tillhör S- och P -blocken i den periodiska tabellen) kan det observeras att den elektroniska affiniteten har en allmän tendens att öka från vänster till höger, på grund av den effektiva kärnbelastningen som kan locka elektroner med större kraft.
Om vi till exempel tar den tredje perioden för den periodiska tabellen kan vi se att den elektroniska affiniteten hos LI (60 kJ/mol) är mindre än syre (141 kJ/mol) och detta är mindre än fluoridens fluorid (328 kJ /mol).
Undantag
Den föregående regeln är inte alltid uppfylld.
Först, när man flyttar från alkaliska metaller till alkaliners, minskar elektronisk affinitet. Detta beror på att för alkaliska metaller (NS elektronisk konfiguration1) Det är gynnsamt att fånga en elektron, eftersom de skulle avsluta fylla sina orbitaler.
När det gäller alkalineros (elektronisk konfiguration NS2) att fånga en elektron är ogynnsamt eftersom de redan har sin fulla orbital. Detsamma händer när man flyttar från halogener (som har de elektroniska affiniteterna i alla element) till de ädla gaserna.
Variation av elektronisk affinitet i en grupp
När det gäller grupper är beteendet ännu mindre förutsägbart. Den allmänna regeln är att a.OCH. ökar från botten upp, i samma riktning som minskar atomradie. För alkaliska och halogenmetaller uppfylls denna regel ganska bra. Detta händer dock inte med de flesta andra grupper.
Kan tjäna dig: kobolthydroxidExempel på elektronisk affinitet hos vissa representativa element
Följande tabell visar elektroniska affinitetsvärden i (kJ/mol) av Representantelementen Sorterat efter grupp:
Nedan följer några exempel på elektronisk affinitet tillsammans med den reaktion som de hänvisar till:
1. Väteelektronisk affinitet
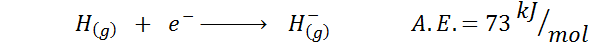
2. Elektronisk syreaffinitet
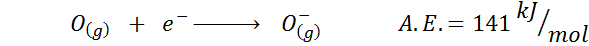
3. Anjonelektronisk affinitet
Ett annat vanligt exempel är fallet med elektronisk affinitet av en anjon som eller-. A.OCH. I detta fall ges det av energin associerad med följande process:
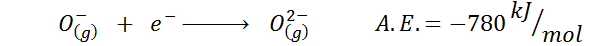
Som man kan se är denna elektroniska affinitet starkt negativ, även om jonen eller2- Den har den elektroniska neonkonfigurationen (en ädel gas) och att vara en mycket vanlig jon i många joniska fasta ämnen.
Anledningen är att avvisningen av negativa avgifter i OR2- Destabiliserar denna gasformiga tillståndjon, men i fast tillstånd stabiliseras lasten av katjonerna som omger den.

