Aufbau princip

- 4156
- 448
- Johan Johansson
 Atomiska orbitalfyllningsorder enligt Aufbau -principen
Atomiska orbitalfyllningsorder enligt Aufbau -principen Vad är Aufbau -principen?
han Aufbau princip, Även känd som den regniga regel- eller konstruktionsprincipen är det en praktisk regel som gör det möjligt att förutsäga den elektroniska konfigurationen av den stora majoriteten av elementen i det periodiska tabellen, liksom dess joner.
Denna princip konstaterar att när protoner läggs till i kärnan, en efter en för att successivt bygga varje kemiskt element, läggs elektronerna också till de minst energiatomiska orbitalerna som finns tillgängliga.
Med andra ord konstaterade Aufbau att det finns en specifik ordning enligt vilken atomiska orbitaler kan fyllas. Denna beställning förklaras nedan.
Ordern för fyllning av orbitalerna enligt principen om Aufbau
Ordningen i vilken atomorbitaler fylls beror på deras energinivå. Den gyllene regeln är att dessa energinivåer är fyllda från minst till största, som om det var en byggnad där lägenheterna bör fyllas i de lägsta golven för att få tillgång till de högsta golven.
I detta avseende, för att förutsäga ordningen på fyllningen av orbitalerna, måste vi först veta hur de beställs enligt deras energinivå. I byggnadsanalogin betyder detta att veta vilka (omloppande) lägenheter som finns på varje våning.
Följande grafik visar energinivåerna för de första atomiska orbitalerna som beställts från lägsta till större energi.
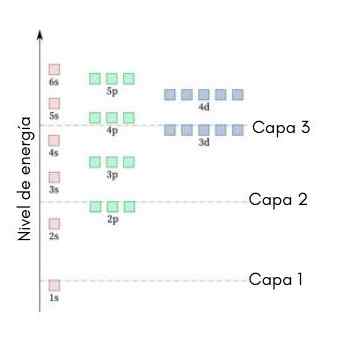
I den här bilden representerar varje bild en viss orbital där endast 2 elektroner passar. Varje grupp målningar av samma färg representerar en undernivå för energi.
Dessa undernivåer identifieras av ett nummer och en bokstav (1s, 3p, 3D, etc.). Antalet indikerar den huvudsakliga energinivån, medan bokstaven anger vilken typ av orbital som bildar gruppen.
Det kan tjäna dig: aluminiumklorid (ALCL3)Enligt detta schema är den första undernivån som måste fyllas 1s (den minsta energin av alla), sedan kommer 2s, 2p, 3s, 3p, 4s, 3d och så vidare.
Regnregeln
Trots hur lätt det är att fastställa ordningen på fyllning om du har en graf som den föregående, är det svårt att komma ihåg den speciella ordningen i vilken de olika undernivåerna går. För detta, vad vissa kallar "regeln om regn" används.
Denna regel består av två enkla steg:
Steg 1
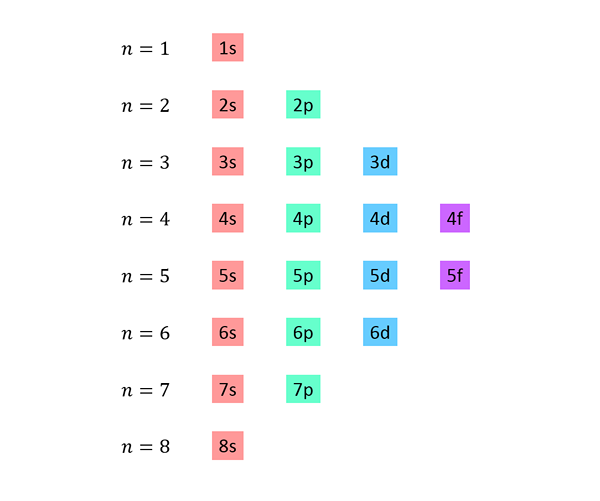
En lista görs där varje rad motsvarar en energinivå och innehåller en efter varandra, alla underavtal tillgängliga på den energinivån.
Till exempel motsvarar den första raden nivå 1 (n = 1) och innehåller endast 1s -sub -nivån; Den andra raden motsvarar nivå n = 2 och innehåller 2s och 2p underavtal; Den tredje innehåller 3S-, 3P- och 3D -undervelarna, och så vidare.
Den kompletta listan ser ut så här:
Steg 2
Fallande diagonaler dras från höger till vänster, den ena under den andra, som visas nedan.
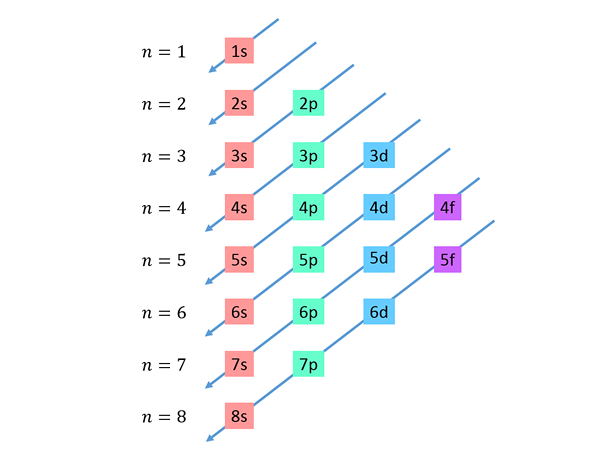
Dessa linjer liknar vattenvägen under en vind med vind, så denna graf kallas vanligtvis "Rain Method". Fyllningsordern bestäms av ordningen i vilken dessa diagonaler berör undernivåerna i listan.
Baserat på den föregående siffran är ordern från orbitalerna och därför ordningen i vilken de måste fyllas:
Kan tjäna dig: kvanttabell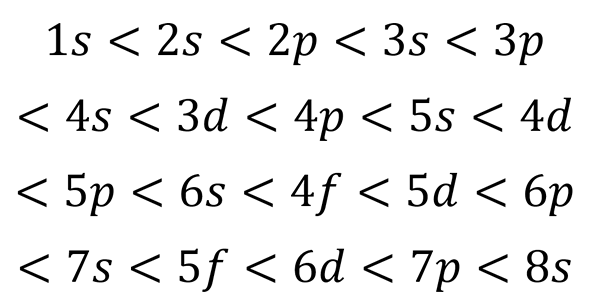
Denna fyllningsorder är den enda som verkligen betyder när man skriver den elektroniska konfigurationen av en atom. När du fyller dessa underavtal måste det komma ihåg att i sub -levelsna s Endast 2 elektroner passar in p passar 6, i d De passar 10 och i F De passar 14.
Undantag i början av Aufbau
Aufbau -principen konstaterar tydligt att en undernivå inte kan fyllas förrän alla tidigare undernivåer har fyllts fullständigt. Det finns dock några undantag från denna regel.
I vissa fall föredrar atomen att ha en undernivå av energi fylld exakt i hälften än att ha en ofullständig som inte är full i hälften. I dessa fall matchar inte den faktiska elektroniska konfigurationen av atomen den förutsagda ordningen med regnmetoden.
Till exempel, enligt Aufbau -principen, bör kromatomen ha en elektronisk konfiguration som slutar i 4s2 3D4. Men dess verkliga konfiguration är 4s1 3D5 Eftersom således 4S- och 3D -sub -nivåerna fylls i hälften medan du är i den andra konfigurationen nr.
Detsamma gäller för koppar vars konfiguration slutar i 4s1 3D10, istället för 4s2 3D9, Eftersom således fyller undernivån D och S är fulla i hälften.
Exempel på tillämpningen av Aufbau -principen
Därefter finns det fem exempel på element som uppfyller Aufbau -principen:
Exempel 1: Natriumelektronisk konfiguration
Natrium är element 11, så det har 11 protoner och 11 elektroner. Dess elektroniska konfiguration är 1s2 2s2 2 p6 3s1.
Exempel 2: Argon elektronisk konfiguration
Argon (AR) är element 18, så det har 18 protoner och 18 elektroner. Dess elektroniska konfiguration är därför 1s2 2s2 2 p6 3s23p6. Det kan ses att hans undernivåer och p sub -nivåer var helt.
Kan tjäna dig: propylen (C3H6)Exempel 3: Elektronisk galliumkonfiguration
Gallium (GA) är element 31, så det har 31 protoner och 31 elektroner. Dess elektroniska konfiguration är 1s2 2s2 2 p6 3s23p64S23D104p1.
Detta kan skrivas på ett sammanfattande sätt som [ar] 4s23D104p1, där [ar] representerar den elektroniska argonkonfigurationen som presenteras i föregående exempel.
Exempel 4: Elektronisk kolkonfiguration
Kol (c) är element 6, så det har 6 protoner och 6 elektroner. Dess elektroniska konfiguration är 1s2 2s2 2 p2.
Exempel 5: Elektronisk klorkonfiguration
Klor (CL) är element 17. Dess 17 elektroner distribueras enligt följande elektroniska konfiguration: 1s2 2s2 2 p6 3s23p5 eller [ne] 3s23p5.
Ytterligare exempel på undantag i början av Aufbau
Därefter finns det ytterligare två exempel på element som bryter mot Aufbau -principen:
Exempel 6: Molybden elektronisk konfiguration
Molybden (MO) är element 42. De första 36 elektronerna distribueras på samma sätt som i Crypton, men dess valenselektroner följer inte den normala ordningen. Istället för att ha elektronisk konfiguration [KR] 5s24d4, Konfigurationen är [KR] 5s14d5, Liknar vad som händer med Chrome.
Exempel 7: Silverelektronisk konfiguration
La Plata (AG, element 47) presenterar en kränkning av Aufbau -principen som liknar koppar. Dess elektroniska konfiguration är [KR] 5s14d10 Istället för [KR] 5s24d9.

