Oktetregel

- 1482
- 133
- Anders Svensson
 Representation av en koldioxidmolekyl som visar överensstämmelse med oktetregeln
Representation av en koldioxidmolekyl som visar överensstämmelse med oktetregeln Vad är oktettregeln?
De Oktetregel Det är en praktisk regel som förklarar bildandet av den kemiska bindningen för de representativa elementen baserat på den elektroniska konfigurationen av dess valensskikt.
Enligt denna regel kombineras atomerna med varandra på ett sådant sätt att varje atom är omgiven av åtta elektroner i sitt valensskikt (därmed ordet oktetten).
Denna regel publicerades samtidigt i 1.916 Både Gilbert Lewis och Walther Kossel. Det återspeglar observationen att ädla gaser är mycket stabila och allt, med undantag för helium, de kännetecknas av att ha sitt valenslager med 8 elektroner.
Teorin fastställer att atomer delar eller utbyter elektroner genom att bilda kemiska bindningar för att få denna fullständiga elektroniska konfiguration.
Octet -regeln och Lewis -strukturerna
Octet -regeln och Lewis -strukturerna är nära besläktade. Detta beror på att oktetregeln är en av baserna för att förstå bildandet av den kemiska bindningen, så det gör det möjligt att i de flesta fall förutsäga Lewis -strukturen för kemikalier.
I detta avseende är ett av de väsentliga stegen för att dra en Lewis -struktur, efter att ha placerat enkla kopplingar mellan alla atomer som bildar molekylen, att distribuera de återstående valenselektronerna bland de mest elektronegativa atomerna för att slutföra sina oktetter.
I fall där oktetter är utan fyllning bildas dubbla eller trippelbindningar, alltid letar du efter oktetregeln för så många atomer som möjligt. Så denna empiriska regel är avgörande för konstruktionen av Lewis -strukturer.
Det kan tjäna dig: Silver Yoduro (AGI): Struktur, egenskaper, erhållning, användningExempel på efterlevnad av oktettregeln
Octet -regeln tillämpas huvudsakligen på de representativa elementen, det vill säga till de för S- och P -blocken i det periodiska tabellen. Denna regel tillämpas konsekvent på föreningar som innehåller kol, kväve, syre och halogener, och med några undantag från de andra elementen i P -blocket. De flesta övergångsmetaller uppfyller dock inte.
Några exempel på föreningar där oktettregeln uppfylls för alla atomer är:
Koldioxid (co2)
Som framgår av Lewis -strukturen i koldioxiden som presenteras nedan, uppfyller både det centrala kolet och båda syreatomerna med oktetregeln.
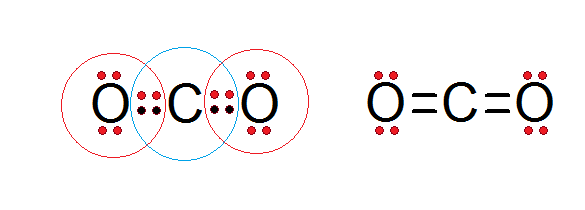
Kol är omgivet av sina fyra valenselektroner, plus två elektroner från varje syre, som bidrar till att bilda dubbelbindningarna C = O, medan varje syre är omgiven av 6 egna elektroner plus ett par från kol.
Neopentano (c5H12)
I de allra flesta organiska föreningar uppfyller alla atomer oktetregeln (med undantag för väte som är omgiven av endast 2 elektroner). Detta inkluderar alkaner som Neopentano eller 2,2-dimetylpropan:
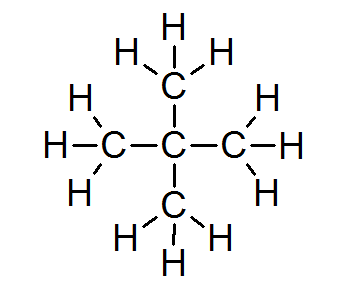
I detta fall kan man också ses att varje kolatom delar sina fyra elektroner med fyra angränsande atomer, som var och en tillhandahåller en av sina elektroner för att bilda de fyra enkla kovalenta bindningarna som håller ihop tillsammans.
Av denna anledning är varje kolatom omgiven av 8 valenselektroner, vilket överensstämmer med oktetregeln.
Kan tjäna dig: aktiveringsenergiKolmonoxid (CO)
Kolmonoxid är en annan molekylär förening där syre- och koldelningselektroner som bildar en kovalent bindning för att tillfredsställa oktetregeln.
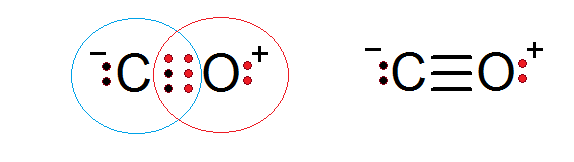
I detta fall tillhandahåller kol två elektroner och syre 4 för att slutföra de 6 elektroner som krävs för att bilda den trippelkovalenta bindningen som förenar dem. Var och en av de två atomerna har ytterligare elektroner utan att dela som slutför varje oktett.
Nitratanjon (nej3-)
Även i fallet med joner är oktetregeln uppfyllt. Nitratjonen har en central kväveatom omgiven av 3 syreatomer.
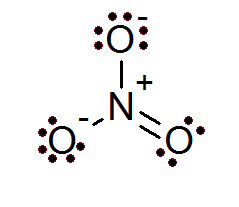
Som framgår av detta fall har alla atomer sin fulla oktett, två av syre har en negativ formell belastning medan kväve har en positiv formell belastning, vilket resulterar i nettobelastningen på -1 nitratjon.
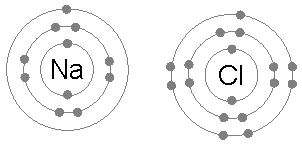
Natriumklorid (NaCl)
Utbytet av elektroner för att bilda joniska föreningar är också ett vanligt exempel på tillämpningen av oktetregeln.
När natriumklorid bildas av klor och natrium, börjar det från två atomer som inte uppfyller oktetregeln, eftersom natrium på en elektron och klor saknar en för att slutföra sin oktet.
Sedan ger natriumet sin elektron till klor och lämnar katjonen omgiven av 8 elektroner och i sin tur slutförde oktetten till klor genom att bilda kloridjonen.
 Undantag från oktetregeln
Undantag från oktetregeln
Precis som det finns ett stort antal föreningar där alla atomer uppfyller oktetregeln finns det också flera exempel på atomer som inte följer det.
Det kan tjäna dig: potentiella z: värden, koaguleringsgrader, beslutsamhet, användningarVissa är omgiven av mindre än 8 elektroner, så de är fattiga elektronarter, Medan andra är omgiven av mer än åtta elektroner, i vilket fall sägs det att det har en utökad oktett eller kallas Hypervalent atom.
Exempel på dåliga elektronarter
Bordean (BH3)
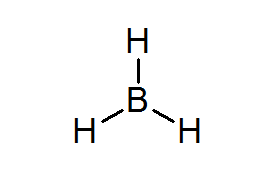
Denna förening är ett typiskt exempel på en dålig typ av elektroner. Varken bor eller de omgivande hydrogenerna har tillräckligt med elektroner för att tillfredsställa oktettregeln i centrala atomen. Detta får Boron att ta emot ett par elektroner från en annan atom i en annan molekyl och förvandla Bordeal till en syra från Lewis.
Aluminium trikurur (alcl3)
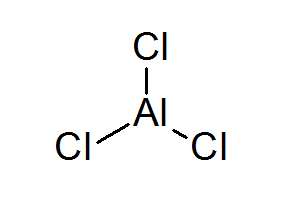
Alcl3 Det är ett annat exempel på en Lewis -syra som är skyldig dess kemiska beteende som den inte uppfyller oktettregeln.
Exempel på hypervaluenta arter
Svavelhexafluoruro (SF6)
Ett typiskt exempel på en utökad oktett är SF6, vilket vanligtvis representeras som ett centralt svavel med 6 enkla kovalenta bindningar med fluoratomer. I det här fallet är svavel omgiven av 12 valenselektroner istället för 8, så det bryter mot oktetregeln.
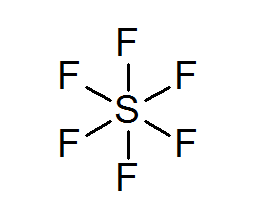
Trots detta har modeller föreslagits där svavel faktiskt är kopplat till kovalenta bindningar till 4 fluorer samtidigt, medan med de andra två bildar joniska bindningar. Om så är fallet skulle det uppfylla oktetregeln.
Fosfor pentaklorid (PCL5)
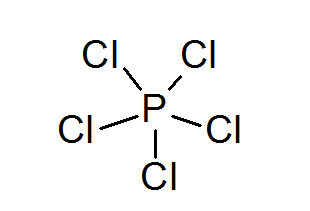
Liksom i fallet med svavel kan fosfor också bilda föreningar med utvidgade oktetter, i detta fall omgiven av 10 elektroner.

