Termisk alkoholstruktur, egenskaper, risker och användningar
- 2193
- 475
- Karl Johansson
han Termisk alkohol Det är en organisk förening vars formel är (ch3)3Coh eller t-buoh. Detta är den enklaste tertiära alkoholen av alla. Beroende på omgivningstemperaturen presenteras den som en fast eller flytande färglös. I den nedre bilden visar de till exempel sina färglösa kristaller.
Denna alkohol är inte ett underlag för enzymet alkoholhydrogenas, eller för den peroxidasiska aktiviteten hos katalas, så det klassificeras som en icke -metaboliserbar alkohol. På grund av dess biokemiska egenskaper tros det att det kan vara användbart vid upptäckt av hydroxiler in vivo i intakta celler.

Det är en av de fyra isomererna av isobutilisk alkohol, som är den mindre mottagliga isomeren till oxidation och det minst reaktiva. I naturen finns det i kikärt och i kassava eller kassava, rot som är jäsad för att producera alkoholhaltiga drycker.
Termisk alkohol är mycket löslig i vatten och organiska lösningsmedel. Dess huvudanvändning är som ett lösningsmedel, vilket uppfyller den rollen i utarbetandet av plast, parfymer, målningsomvändare etc.
Liksom många organiska föreningar är det lite giftigt, men i höga doser har den en narkotisk effekt, kännetecknad av huvudvärk, vahidos, yrsel, yrsel och förfall.
[TOC]
Termisk alkoholstruktur
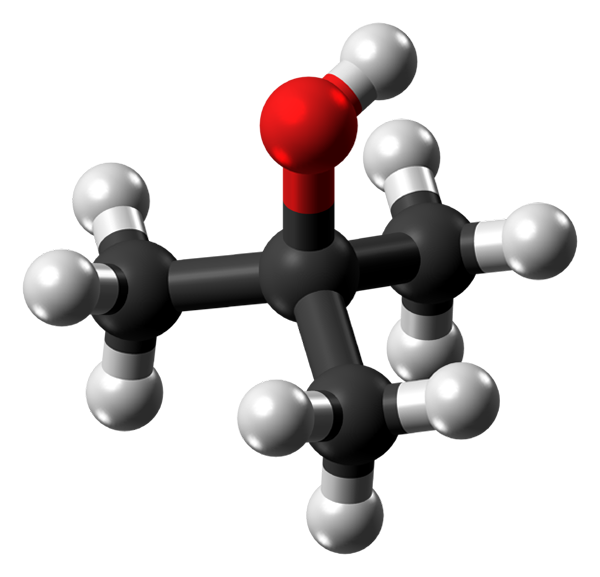
 Termisk alkoholmolekyl. Källa: Jynto via Wikipedia.
Termisk alkoholmolekyl. Källa: Jynto via Wikipedia. I den övre bilden har du molekylstrukturen för termisk alkohol med en modell av sfärer och staplar. Hela molekylen har en global tetraedral geometri, med det tredje kolet beläget i centrum, och grupperna3 och åh i sina toppar.
Iakttagande av denna struktur är det underförstått varför denna alkohol är tertiär: centrumets kol är kopplat till tre andra kolhydrater. Fortsätter med tetrahedronen kan den nedre delen av den betraktas som apolär, medan dess övre toppunkt, polära.
Det kan tjäna dig: Fehling Reaction: Preparations, Active Agents, Exempel, användningarI detta toppunkt är OH-gruppen, som skapar en permanent dipol och också tillåter T-Buoh-molekyler att interagera genom vätebroar; På samma sätt som det gör med vattenmolekyler och andra polära ämnen.
I T-Buah-kristaller är dessa vätebroar en nyckelfaktor för molekylerna att förbli tillsammans; Även om det inte finns för mycket information om vad som är den kristallina strukturen i denna alkohol.
När OH -gruppen är så nära och omgiven av de apolära grupperna Cho3, Vattenmolekyler lyckas hydrera nästan all alkohol medan de interagerar med OH. Detta skulle förklara dess stora löslighet i vatten.
Egenskaper
Kemiska namn
-Termisk alkohol
-Ter -butanol
-2- Metyl-2-propanol
-2-metylpropan-2-ol.
Molekylär formel
C4H10O o (cho3)3Koh.
Molekylvikt
74,123 g/mol.
Fysisk beskrivning
Färglös fast eller färglös vätska, beroende på omgivningstemperaturen, eftersom smältpunkten är 77,9 ºF (25,4 ºC). Över 77,9 ºF är en vätska.
Lukt
Liknande kamfer.
Kokpunkt
82,4 ºC.
Smältpunkt
77,9 ºF (25,4 ºC).
antändningspunkt
52 ºF (11 ºC). Stängd kopp.
Vattenlöslighet
Mycket löslig. I själva verket, oavsett proportioner, är denna alkohol alltid blandbar med vatten.
Löslighet i organiska lösningsmedel
Belopp med etanol, etyleter och löslig i kloroform.
Densitet
0,78 g/cm3.
Ångtäthet
2,55 (med luftrelation = 1).
Ångtryck
4,1 kPa vid 20 ºC.
Oktanol/vattenpartitionskoefficient
Log P = 0,35.
Termostabilitet
Instabilt i värme
Självriktningstemperatur
896 ºF (470 ºC).
Kan tjäna dig: alikvot (kemi)Sönderfall
När uppvärmd kan frigöra kol- och isobutilenmonoxidångor.
Förångningsvärme
39,07 kJ/mol.
Kaloriförmåga
215,37 JK-1mol-1.
Träningsparthy
-360.04 till -358.36 kjmol-1.
Förvaringstemperatur
2-8 ºC.
Stabilitet
Det är stabilt, men oförenligt med starka oxidationsmedel, koppar, kopparlegeringar, alkaliska och aluminiummetaller.
Joniseringspotential
9,70 eV.
Lukttröskel
219 mg/m3 (låg lukt).
Brytningsindex
1 382 till 25 ° C.
Dissociationskonstant
PKA = 19,20.
Maximal ångkoncentration
5,53 % vid 25 ºC.
Reaktioner
-Det är obehagligt med en stark bas för att orsaka en alkoxidanjon; Specifikt en terbutoxid, (ch3)3Co-.
-Termisk alkohol reagerar med väteklorid för att bilda terbutylkloriden.
(Ch3)3Coh +hcl => (ch3)3CCL +H2ANTINGEN
Tertiära alkoholer har större reaktivitet med vätehalogenider än sekundära och primära alkoholer.
Risker
Termisk alkohol genom kontakt med huden producerar milda lesioner, såsom erytem och icke -seriös hyperemi. Dessutom korsar den inte huden. Tvärtom, i ögonen ger det allvarlig irritation.
När den inhaleras producerar den irritation i näsan, halsen och bronchi. Vid hög exponering kan narkotiska effekter, ett tillstånd av dåsighet, såväl som blekning, vahidos och huvudvärk uppstå.
Denna alkohol är ett experimentellt teratogent medel, så det har observerats hos djur som kan påverka utseendet på medfödda störningar.
När det gäller lagring är dess vätska och ångor brandfarliga, och därför kan det under vissa omständigheter generera bränder och explosioner.
OSHA etablerade en koncentrationsgräns på 100 ppm (300 mg/m3) Under en 8 -timmars dag.
Kan tjäna dig: procentuella lösningarAnsökningar
-Termisk alkohol används för att införliva den termiska gruppen i organiska föreningar för att förbereda lösliga oljor i oljor och trinitro-tter-buttletoluen, en konstgjord mysk. Dessutom utgör det ett initialt material för framställning av peroxider.
-Det har godkänts av FDA som ett splängmedel att använda i komponenter och plastmaterial som är i kontakt med mat. Det har använts i utarbetandet av frukt, plast och lacas -essenser.
-Det är en mellanhand för produktion av terbutyl och tributilfenolklorid. Det fungerar som ett denaturerande medel för etanol.
-Servera för tillverkning av flotationsmedel, som ett organiskt lösningsmedel för att ta bort målningar och för att lösa essenser som används i parfymer.
-Det används som en oktanförstärkare i bensin; bränsle- och bränsletillsats; Lösningsmedel som ska användas vid rengöring och som en eländig.
-Termisk alkohol är ett mellanhandligt medel i produktionen av terbutylmetyletern (MTBE) och tributiletyleter (ETBE), reagerar respektive med metanol och etanol.
-Det verkar också på samma sätt i produktionen av tributylhydroperoxid (TBHP) genom reaktion med väteperoxid.
-Det används som ett reagens i processen som kallas Curtius bakreglo.
Referenser
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10th Utgåva.). Wiley Plus.
- Wikipedia. (2019). Tert-butylalkohol. Hämtad från: i.Wikipedia.org
- Commonorganicchemi. (s.F.). T-butanol. Återställt från: CommonorganicChemistry.com
- Nationellt centrum för bioteknikinformation. (2019). Tert Butanol. Pubchemdatabas. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Carey f. TILL. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- « Attitudinalt innehåll Egenskaper och exempel
- Vad ska barn och ungdomar från 2000 -talet lära sig att agera i dagens värld? »

