Anisolstruktur, egenskaper, nomenklatur, risker och användningar
- 4577
- 466
- Prof. Erik Johansson
han anisol eller metoxibensen Det är en organisk förening som består av en aromatisk eter vars kemiska formel är c6H5Ägg3. Hans fysiska tillstånd är det av en färglös vätska, som kan presentera gula färg. Det är lätt att känna igen av dess karakteristiska lukt av anis.
Det är då en flyktig förening och inte så höga sammanhållningskrafter; Vanliga egenskaper i ljusetrar, som lagras i små förseglade containrar. Specifikt är anisol den enklaste av alkyl auril eter; Det vill säga de med en aromatisk komponent (AR) och en annan alkyl (R), AR-O-R.
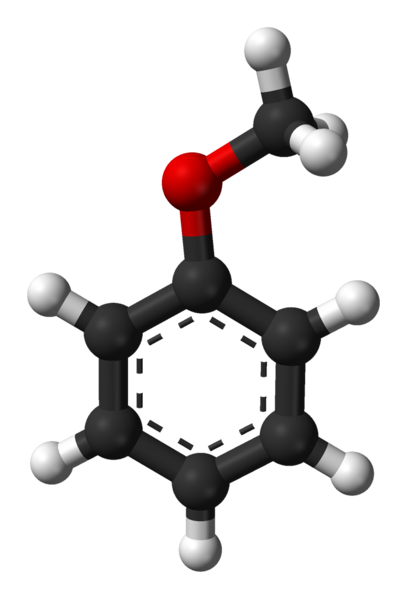
 Anisolmolekyl. Källa: Ben Mills via Wikipedia.
Anisolmolekyl. Källa: Ben Mills via Wikipedia. Grupp c6H5- kommer att beteckna ar och -ch3 En r, därmed har C6H5-O-ch3. Den aromatiska ringen och närvaron av -och3 Som en substituentgrupp som kallas Metoxi ger Anisol en nukleofilicitet överlägsen den hos bensen och nitrobensen. Därför fungerar det som en mellanhandsmolekyl för syntes av föreningar med farmakologisk aktivitet.
Dess karakteristiska lukt av anis har använts för att lägga till anisol till kosmetiska och hygienprodukter som kräver en trevlig doft.
[TOC]
Anisolstruktur
I den övre bilden visas molekylstrukturen hos anisol med hjälp av en sfärer och staplarmodell. Den aromatiska ringen uppskattas, vars kol är sp2 och därför är det platt, som ett hexagonalt ark; Och kopplat till honom är metoxi -gruppen, vars kol är SP3, och dess hydrogener är över eller under ringplanet.
Betydelsen av -och -gruppen3 I strukturen går det utöver att bryta med molekylens platta geometri: den ger den polaritet, och följaktligen förvärvar bensenpolär molekyl ett permanent dipolmoment.
Dipolärt ögonblick
Detta dipolmoment beror på syreatomen, som lockar de elektroniska tätheterna i både aromatisk och metylring. Tack vare detta kan Anisols molekyler interagera halvdipolokrafter; Även om det saknar någon möjlighet att bilda vätebroar, eftersom det är en eter (ROR har inget syretänkat).
Kan tjäna dig: natriumklorid (NaCl)Dess höga kokpunkt (154 ° C), intygar experimentellt de starka intermolekylära interaktioner som styr dess vätska. På samma sätt är Dispersion Forces i London närvarande, beroende på molekylmassan och π -π -interaktioner mellan själva ringarna själva.
Kristaller
Anisols struktur tillåter honom dock inte.F = -37ºC). Detta kan också bero på att när intermolekylära avstånd reduceras, är elektrostatiska avstötningar mellan angränsande aromatiska ringar mycket starka.
Därför, och enligt kristallografiska studier, kan anisolmolekyler i kristaller vid en temperatur av -173 ° C inte beställas på ett sådant sätt att deras ringar står inför; Det vill säga dess aromatiska centra är inte i linje med varandra, utan en grupp -och3 Det är upp eller under en angränsande ring.
Egenskaper
Fysiskt utseende
Färglös vätska men det kan presentera milda färgade halmtoner.
Lukt
Det luktar något lik anisfrön.
Smak
Ljuv; Men det är måttligt giftigt, så detta test är farligt.
Molekylär massa
108,140 g/mol.
Densitet
0,995 g/ml.
Ång-densitet
3,72 (i luftrelation = 1).
Smältpunkt
-37ºC.
Kokpunkt
154ºC.
antändningspunkt
125ºC (Open Cup).
Självriktningstemperatur
475ºC.
Gegga
0,778 CP vid 30 ° C.
Ytspänning
34.15 DINS/CM A 30 ° C.
Brytningsindica
1,5179 till 20 ° C.
Löslighet
Dåligt lösligt i vatten (cirka 1 mg/ml). I andra lösningsmedel, såsom aceton, etrar och alkoholer, är det ändå mycket lösligt.
Nukleofilicitet
Anisols aromatiska ring är rik på elektroner. Detta beror på att syre, trots att det är en mycket elektronegativ atom, bidrar med elektronerna i deras π -moln för att demociera dem genom ringen i många resonansstrukturer. Följaktligen reser fler elektroner det aromatiska systemet och ökar därför dess nukleofilicitet.
Det kan tjäna dig: Kamphorös alkohol: Struktur, formel, egenskaper och användningarExperimentellt har ökningen av nukleofilicitet visats genom att jämföra dess reaktivitet, inför aromatiska elektrofylsubstitutioner, med den hos bensen. Således bevisas den anmärkningsvärda effekten av -och -gruppen3 På de kemiska egenskaperna hos föreningen.
Det bör också noteras att elektrofila substitutioner förekommer i angränsande positioner (-orto) och motsatt (-for) till metoxi-gruppen; det vill säga detta är orto-för regissör.
Reaktivitet
Anisols aromatiska ring nukleofilicitet gör att du redan kan skymta hur dess reaktivitet är. Substitutionerna kan hända antingen i ringen (gynnas av dess nukleofilicitet) eller i samma metaxi -grupp; I det senare är O-C-länken trasig3 För att ersätta -ch3 av en annan alquilisk grupp: O-Alquilación.
Därför kan Anisol i en alkyleringsprocess acceptera en grupp R (fragment av en annan molekyl) som ersätter en H av sin ring (C-levande) eller ersätta CH3 Från din Metoxi -grupp. Följande bild illustrerar vad som just sägs:
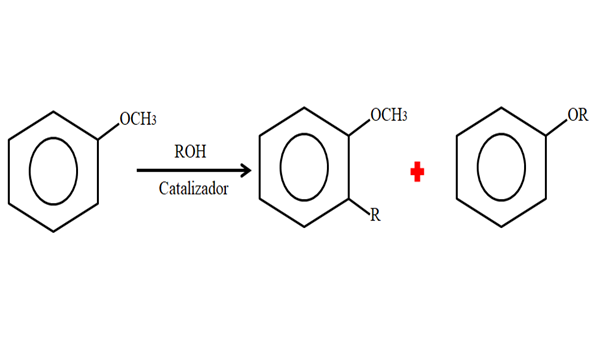 Anisolalkylering. Källa: Gabriel Bolívar.
Anisolalkylering. Källa: Gabriel Bolívar. På bilden är R -gruppen belägen i position -orto, men det kan också vara i position -för, motsatt till -och3. När o -alquilación inträffar, erhålls en ny eter med en annan grupp -eller.
Nomenklatur
Namnet 'Anisol' är det mest kända och accepterade, troligen härrörande från dess lukt som liknar anis. Emellertid är namnet "Metoxibenzen" ganska specifikt, eftersom det upprättar en gång strukturen och identiteten för denna aromatiska eter; Detta är namnet som styrs av den systematiska nomenklaturen.
Ett annat mindre använt namn, men lika giltigt, är 'fenylmetyleter', som styrs av den traditionella nomenklaturen. Detta är kanske det mest specifika namnet på alla, eftersom det direkt indikerar vilka som är de två strukturella delarna av etern: Phoenyl-O-metyl, C6H5-O-ch3.
Risker
Medicinska studier har ännu inte kunnat visa de möjliga dödliga effekterna av anisol på kroppen vid låga doser. Men som nästan alla kemiska ämnen producerar det irritationer när för tid utsätts och i måttliga koncentrationer för huden, halsen, lungorna och ögonen.
Kan tjäna dig: Amagat Law: Förklaring, exempel, övningarPå grund av nukleofiliciteten i hans ring är en del av den metaboliserad och är därför biologiskt nedbrytbar. Som ett resultat av denna egenskap visade faktiskt simuleringar att den inte koncentrerar sig på vattenhaltiga ekosystem sedan dess organismer först försämrade den; Och därför kan floder, sjöar eller hav samla anisol.
I jordarna, med tanke på dess volatilitet, förångas den snabbt och dras av luftströmmar; Således påverkar inte heller grönsaksmassor eller plantager avsevärt.
Å andra sidan reagerar atmosfäriskt med fria radikaler och representerar därför inte en risk för luftföroreningar som vi andas.
Ansökningar
Organisk syntes
Från anisol kan andra derivat erhållas genom aromatisk elektrofil substitution. Detta gör det möjligt att användas som mellanhand för syntes av läkemedel, bekämpningsmedel och lösningsmedel, som vill lägga till sina egenskaper. Syntetiska rutter kan bestå av en mestadels.
Doft
Förutom dess användning för organisk syntes kan den användas direkt som ett tillsatsmedel för krämer, salvor och parfymer, som innehåller anti -dofter i sådana produkter.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. TILL. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Nationellt centrum för bioteknikinformation. (2019). Anisol. PubChem -databas, CID = 7519. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2019). Anisol. Hämtad från: i.Wikipedia.org
- Pereira, Cynthia C. M., De la cruz, marcus h. C., & Lachter, Elizabeth R. (2010). Flytande faselation av anisol och fenol katalyserad av niobfosfat. Journal of the Brazilian Chemical Society, 21 (2), 367-370. Dx.doi.org/10.1590/S0103-50532010000200025
- Seidel r. W. och Goddard R. (2015). Anisole vid 100 K: Den första kristallstrukturbestämningen. Crystallogr C Struct Chem Act. Aug; 71 (Pt 8): 664-6. Doi: 10.1107/s2053229615012553
- Kemisk formulering. (2018). Metoxibensen. Återhämtad från: Quimica -formulering.com

