Träningskat, skillnader med anjon och exempel
- 4107
- 578
- Lars Eriksson
En katjon Det är en kemisk art som har en positiv laddning. De två typerna av befintliga joner är för anjonen. Dess belastning är produkten av en elektronbrist i atomen, vilket får kärnprotonerna att utöva en större attraktion. För varje elektron som förlorar en neutral atom ökas den positiva belastningen i en enhet.
Om en atom tappar en elektron, och därför är antalet protoner större än en, kommer dess positiva belastning att vara +1; Om du tappar två elektroner kommer lasten att vara +2 och så vidare. När en katjon har en +1 -belastning sägs den vara monovalent; Å andra sidan, om nämnda belastning är större än +1, sägs det att katjonen är mångsidig.
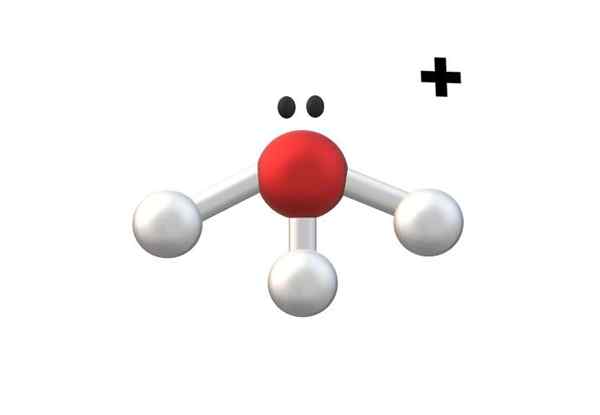
 Hydroniojon, en av de enklaste katjonerna katjoner. Källa: Gabriel Bolívar.
Hydroniojon, en av de enklaste katjonerna katjoner. Källa: Gabriel Bolívar. I den övre bilden visas det till katjon h3ANTINGEN+, kallas hydroniojon. Som man kan se har den knappt en +1 belastning, i enlighet med en monovalent katjon.
Katjoner är viktiga arter, eftersom de utövar en elektrostatisk kraft med sin miljö och molekylerna runt. De har en hög interaktion med vatten, vätska som hydratiserar och transporterar dem i våta jordar, och sedan når växternas rötter och användas för deras fysiologiska funktioner.
[TOC]
Hur bildas en katjon?
Det nämndes att när en atom tappar en elektron, utövar det största antalet protoner, i förhållande till elektroner, en attraktionskraft som innebär en positiv belastning. Men hur kan elektronförlust uppstå? Svaret beror på omvandlingen som inträffade i kemiska reaktioner.
Det bör noteras att närvaron av en atom med positiv belastning inte nödvändigtvis innebär bildning av en katjon. Så att det kan betraktas som sådant bör det inte finnas en atom med en negativ formell belastning som neutraliserar. Annars skulle det vara attraktion och avvisande inom samma förening och skulle vara neutrala.
Kan tjäna dig: kalciumsulfat (case4): kemisk struktur, egenskaper, användningarFormella avgifter och fler länkar
Elektronegativa atomer lockar elektronerna i deras kovalenta bindningar mot dem. Även om elektroner delas lika, finns det en punkt där de delvis kommer att ha mindre elektroner än i sin basalkonfiguration; Detta är det för deras fria atomer utan att vara kopplade till andra element.
Sedan kommer dessa elektronegativa atomer att börja uppleva en elektronbrist, och med den kommer protonerna i deras kärnor att utöva en kraft av större attraktion; Den positiva formella belastningen är född. Om det bara finns en positiv formell belastning kommer föreningen att manifestera en global positiv jonisk belastning; Således föddes katjonen.
Syreatomen i katjon h3ANTINGEN+ Det är ett troget exempel på ovanstående. Genom att ha tre O-H-bindningar, en mer än i vattenmolekylen (H-O-H), upplever förlusten av en elektron med avseende på dess basala tillstånd. Beräkningarna av de formella belastningarna gör det möjligt att bestämma när detta händer.
Om bildningen av en annan O-H antas för ett ögonblick kommer den divalenta katjonen att erhållas4ANTINGEN2+. Observera att den tvåvärda belastningen ovanpå katjonen är skriven enligt följande: Antalet följde '+' symbolen; På samma sätt fortsätter anjonerna.
Oxidation
Metaller är katjonformatorer par excellence. Men inte alla kan bilda kovalenta bindningar (eller åtminstone rent kovalent). Istället förlorar de elektroner för att upprätta jonbindningar: en positiv belastning lockar en negativ, förenad av fysiska krafter.
Därför förlorar metaller elektroner för att flytta från M till Mn+, var n Det är vanligtvis lika med antalet din grupp i den periodiska tabellen; fastän n Du kan ta flera hela värden, vilket förekommer särskilt med övergångsmetaller. Denna förlust av elektroner utförs i en typ av kemisk reaktion som kallas oxidation.
Kan tjäna dig: tertiär alkohol: struktur, egenskaper, exempelMetallerna oxiderar, förlorar en elektron, antalet protoner av deras atomer överstiger det för elektroner och uppvisar följaktligen en positiv belastning. För att det ska finnas oxidation måste det finnas ett oxidationsmedel, vilket minskar eller får elektroner som förloras av metaller. Syre är det mest kända oxidationsmedel av alla.
Skillnader med anjon
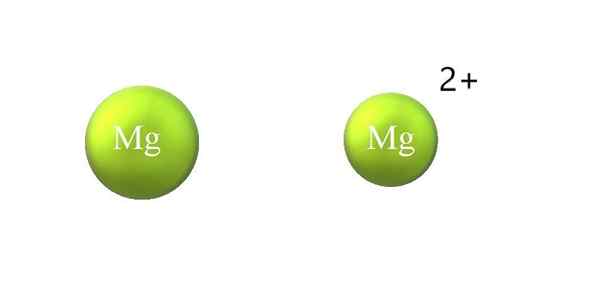 Atomisk radie sammandragning i en katjon. Källa: Gabriel Bolívar.
Atomisk radie sammandragning i en katjon. Källa: Gabriel Bolívar. Nedan följer skillnaderna mellan en katjon och anjon:
-Den allmänna katjonen är mindre än anjon. Den övre bilden visar hur atomradie för MG reduceras genom att förlora två elektroner och bli MG -katjon2+; Det motsatta inträffar med anjoner: de blir mer skrymmande.
-Den har fler protoner än elektroner, medan anjon har fler elektroner än protoner.
-Att vara mindre är dess lastdensitet högre och har därför större polariserande kraft; det vill säga deformerar de elektroniska molnen hos angränsande atomer.
-En katjon rör sig i samma riktning som den för det applicerade elektriska fältet, medan anjonen gör det i motsatt riktning.
Exempel på de vanligaste katjonerna
Monoatomisk
Monoatomiska katjoner kommer mestadels från metaller (med undantag för vissa undantag, till exempel h+). Av resten är det extremt sällsynt att överväga en katjon härrörande från ett icke -metalliskt element.
Det kommer att ses att många av dem är di eller mångsidiga, och att storleken på deras laster överensstämmer med antalet grupper i det periodiska tabellen.
Det kan tjäna dig: Ribulosa-1,5-bifosfat (RUBP): Egenskaper, Carbolixation-Li+
-Na+
-K+
-RB+
-Cs+
-Fr+
-Ag+
Alla har gemensamt belastningen '1+', som är skriven utan att placera numret, och kommer också från grupp 1: alkaliska metaller. Dessutom finns det katjonen+, En av de vanligaste övergångsmetallerna.
-Vara2+
-Mg2+
-Växelström2+
-herr2+
-Ba2+
-Ra2+
Dessa divala katjoner härstammar från deras respektive metaller som tillhör grupp 2: Alkalinerior metaller.
-Till3+
-Ga3+
-I3+
-Tl3+
-Nh3+
Trivalenta katjoner av Boro -gruppen.
Hittills har exemplen kännetecknats av att ha en enda valens eller lastning. Andra katjoner uppvisar mer än en valens eller positivt oxidationstillstånd:
-Sn2+
-Sn4+ (tenn)
-Co2+
-Co3+ (kobolt)
-Au+
-Au3+ (guld)
-Tro2+
-Tro3+ (järn)
Och andra metaller, som mangan, kan fortfarande ha många fler valenser:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Ju större last, mindre och polariserande är katjonen.
Polyiatomisk
Utan att gå in i organisk kemi finns det oorganiska och polylamiska katjoner som är mycket vanliga i det dagliga livet; Till exempel:
-H3ANTINGEN+ (Hydronio, redan nämnt).
-Nh4+ (ammonium).
-NEJ2+ (Nitronio, närvarande i nitreringsprocesser).
-PH4+ (Fosfonium).
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (5 maj 2019). Definition och exempel katjon. Återhämtat sig från: tankco.com
- Wyman Elizabeth. (2019). Katjon: Definition & exempel. Studie. Återhämtat sig från: studie.com
- Dumheter. (2019). Positiva och negativa ins: katjoner och anjoner. Återhämtat sig från: dummies.com
- Wikipedia. (2019). Katjon. Återhämtad från: är.Wikipedia.org
- « Anisolstruktur, egenskaper, nomenklatur, risker och användningar
- Arkeolitiskt ursprung, egenskaper, klimat, flora och fauna »

