Arsenikhistoria, struktur, egenskaper, användningar

- 2735
- 671
- Lars Eriksson
han arsenik Det är en semimetal eller metalloid som tillhör grupp 15 eller går från det periodiska tabellen. Det representeras av den kemiska symbolen som och har atomnumret 33. Det kan vara under tre allotropiska former: gul, svart och grå; Det senare är den enda med industriell betydelse.
Gray Arsenic är en metallisk, bräcklig -ser fast, med en steely och kristallin färg (lägre bild). Förlorar sin ljusstyrka när den utsätts för luftformning av arseniosooxid (som2ANTINGEN3), som när upphettas avger en lukt av vitlök. Å andra sidan är dess gula och svarta alotrochos molekylära respektive amorfa.
 Metallarsenik. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]
Metallarsenik. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] Arsenik ligger i jordskorpan i samband med många mineraler. Endast en liten andel är i ett infödt tillstånd, men förknippat med antimon och silver.
Bland de vanligaste mineralerna där arsenik är följande är: Rejalgar (som4S4), oropimentet (som2S3), Loellita (ful2) och enargita (cu3Röv4). Arsenik erhålls också som en säkerhetsprodukt av gjuteriet av metaller som bly, koppar, kobolt och guld.
Arsenikföreningar är giftiga, särskilt Arsina (Ash3). Arsenik har emellertid många industriella tillämpningar, inklusive legering med bly, som används i utarbetandet av bilbatterier, och legeringen med gallium med flera användningsområden inom elektronik.
[TOC]
Historik om din upptäckt
Det "arsenik" -namnet kommer från Latin Arsenicum och den grekiska arsenikon, med hänvisning till Yellow Oropiment, som utgjorde den huvudsakliga formen för användning av arsenik av alkemister.
Arsenik långt innan den erkänns som ett kemiskt element, var känd och användes i form av dess föreningar. Till exempel Aristoteles under det fjärde århundradet.C. Han skrev om Sandarache, ett ämne som nu tros att det var arseniksulfid.
Plinio El Viejo och Pivanio Discorides, på 1: a århundradet.C., De beskrev Oropimentet, ett mineral som bestod av2S3. Under det elfte århundradet erkändes tre arsenikarter: vit (som4ANTINGEN4), Den gula (som2S3) och röd (som4S4).
Arsenik som ett rent element observerades för första gången av Albertus Magnus (1250). Magnus uppvärmd arseniksulfid med tvål, märker utseendet på ett ämne med en egenskap som liknar den gråa bildbilden av bilden. Den första autentiska rapporten om dess isolering publicerades emellertid 1649 av Johann Schroeder, en tysk farmaceut.
Schroeder förberedde arsenik genom att värma sin koloxid. Därefter lyckades Nicolas Lémery värma det genom att värma en blandning av arsenikoxid, tvål och potash. På 1700 -talet erkändes detta element äntligen som en semimetal.
Det kan tjäna dig: inga elektrolyter: egenskaper och exempelArsenikstruktur
Arsenik är isomorfisk mot antimon; Detta är, strukturellt är de identiska, skiljer sig bara i storleken på sina atomer. Varje atom av arsenik bildar tre som kovalenta bindningar, på ett sådant sätt att de också har sitt ursprungliga hexagonala enheter6 "Rynkad eller brant", sedan hybridiseringen av As atomer är SP3.
Sedan enheterna6 De ansluter sig till branta arseniska lager, som interagerar svagt med varandra. Efter deras intermolekylära krafter, främst beroende av deras atommassor, ger de grå arsenik rhomneniska kristallerna en bräcklig och spröd struktur.
Eventuellt på grund av arseniska elektroner, enheterna6 Bildad mellan parallella lager definierar inte en perfekt octahedron men förvrängd:
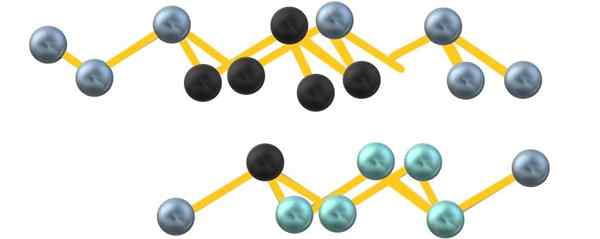 Grå arsenisk kristallinstruktur. Källa: Gabriel Bolívar.
Grå arsenisk kristallinstruktur. Källa: Gabriel Bolívar. Observera att de svarta sfärerna drar det förvrängda planet i utrymmet mellan två branta lager. I skiktet nedan finns det också blåiga sfärer som bredvid den svarta sfären utgör enheten6 nämndes i början av avsnittet.
Strukturen ser beställd ut, raderna stiger och går ner och är därför kristallin. Du kan dock bli amorf, med pressade sfärer på olika sätt. När gråaktig arsenik blir amorf blir det en halvledare.
Gul arsenik
Den gula arseniken, den mest giftiga alotropiken i detta element, är bara ett molekylärt fast ämne. Består av som molekyler4 enheter av svaga spridningskrafter, som inte hindrar dem från att flyktiga.
Svart arsenik
Svart arsenik är amorf; Men inte hur kan den gråaktiga alotropen vara. Dess struktur är något lik den senaste6 De har större områden och olika störningsmönster.
Elektronisk konfiguration
[AR] 3D104S24p3
Har alla orbitaler i nivå 3 full. Formlänkar med 4S- och 4P -orbitaler (såväl som 4D) med olika kemiska hybridiseringar.
Egenskaper
Molekylvikt
74,922 g/mol
Fysisk beskrivning
Grå arsenik är en gråaktig metallisk -ser fast och spröd konsistens.
Färg
Tre allotropiska former, gul (alfa), svart (beta) och grå (gamma).
Lukt
Toalett
Smak
Smaklös
Smältpunkt
1.090 K vid 35,8 atm (Triple Arsenic Point).
Vid normalt tryck har ingen fusionspunkt, eftersom det sublimerar 887 K.
Densitet
-Grå arsenik: 5,73 g/cm3.
Det kan tjäna dig: karbonylgrupp: egenskaper, egenskaper, nomenklatur, reaktivitet-Gul arsenik: 1,97 g/cm3.
Vattenlöslighet
Olöslig
Atomradio
139
Atomvolym
13,1 cm3/mol
Radiokovalent
120
Specifik värme
0,328 j/g · mol vid 20 ºC
Förångningsvärme
32,4 kJ/mol
Elektronnegativitet
2,18 på Pauling -skalan
Joniseringsenergi
Första joniseringsenergi 946,2 kJ/mol
Oxidationstillstånd
-3, +3, +5
Stabilitet
Elemental arsenik är stabil i torr luft, men när den utsätts för den fuktiga luften är den täckt med ett gult-bronsskikt som kan bli ett svart skikt av arsenisk oxid (2ANTINGEN3).
Sönderfall
När arsenik värms upp för att sönderdelas avger den en vit rök från som2ANTINGEN3. Förfarandet är farligt eftersom Arsina också kan släppas ut, en mycket giftig gas.
Självriktning
180 ºC
Hårdhet
3.5 På Mohs hårdhetsskala.
Reaktivitet
Det attackeras inte av kallt svavelsyra eller koncentrerad saltsyra. Reagerar med salpetersyra eller varm svavelsyra och bildar arsenös syra och arseninsyra.
När Gray Arsenic är förångad av uppvärmning och ångor snabbt kyls, bildas en gul arsenik. Detta återgår till den gråaktiga formen, när den utsätts för ultraviolett ljus.
Ansökningar
Legeringar
En liten mängd arsenik som läggs till bly, härdar sina legeringar tillräckligt för att använda dem i kablarnas foder och i utarbetandet av bilbatterier.
Tillsatsen av arsenik till mässingen, en legering av koppar och zink, ökar dess motstånd mot korrosion. Å andra sidan korrigerar eller minskar det förlusten av zink i mässingen, vilket orsakar en ökning av dess livslängd.
elektronik
Renad arsenik används i halvledarteknologi där den används i samband med Gallic.
Gaas har ett direktbandsintervall, som kan användas vid tillverkning av dioder, laser och LED. Förutom Gallium arseniuro finns det andra arseniuros, såsom indiska arseniuro och aluminium arseniuro, som också utgör II-V halvledare.
Under tiden är kadmium arseniuro en halvledare av typ II-IV. Arsina har använts i halvledardoping.
Jordbruk och bevarande av trä
De flesta applikationer har kasserats på grund av deras stora toxicitet och deras föreningar. As2ANTINGEN3 har använts som bekämpningsmedel, medan esset2ANTINGEN5 Det är en ingrediens i herbicider och insekticider.
Arseninsyra (h3Aso4) och salter som kalcium och blyarsenat har använts för att sterilisera jord och kontrollera skadedjur. Detta genererar en risk för miljöföroreningar med arsenik.
Kan tjäna dig: flytande element: vad är och exempelLead Arseniato användes som insektsmedel i fruktträd, fram till första hälften av det tjugonde århundradet. Men på grund av dess toxicitet ersattes den av natriummetylarsenat, som slutade användas av samma anledning sedan 2013.
Medicinsk
Fram till det tjugonde århundradet användes flera av deras föreningar som läkemedel. Arsfenamina och Neolsalvarsan, till exempel, användes vid behandling av syfilis och triposomiasis.
År 2000 godkändes användningen av AS2ANTINGEN3, Mycket giftig förening, vid behandling av akut promineo-resistent som lovar att retino-trans-sur syra. Nyligen användes den radioaktiva isotopen 74När det gäller tumörer.
Isotopen producerar bra bilder, tydligare än de som erhålls med 124Jag, eftersom jod föras till sköldkörteln och producerar brus i signalen.
Andra användningsområden
Arsenik användes tidigare som ett tillsatsfoder i produktionen av fjäderfä och grisar.
Det används som en katalysator inom tillverkning av etenoxid. Det används också i pyroteknik och solbränna. Arsenioso -oxid används som en avfärgad i glasstillverkning.
Var ligger det?
Arsenik finns i små mängder i ett elementärt tillstånd, med en hög grad av renhet. Det finns i många föreningar, till exempel: sulfider, arsenuros och sulfarseniuros.
Det finns också i flera mineraler, inklusive: Arsenopyrite (Fesas), Loellita (ful2), enargita (cu3Röv4), oropimentet (som2S3) Och Rejalgar (som4S4).
Hur erhålls det?
Arsenopirita värms upp till 650-700 ºC, i frånvaro av luft. Arsenik avdunstar och lämnar järnsulfid (FES) som en rest. Under denna process binder arsenik till syre för att bilda4ANTINGEN6, känd som "White Arsenic".
As4ANTINGEN6 Det är modifierat för att bilda AS2ANTINGEN3, vars ångor samlas in och kondenseras i en uppsättning tegelkameror, renande arsenik genom sublimering.
Det mesta av arsenik produceras genom att minska dammets kol som bildas från2ANTINGEN3.
Referenser
- Stephen r. Marsden. (23 april 2019). Arsenikkemi. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (3 december 2018). Intressanta fakta om arsenik. Återhämtat sig från: tankco.com
- Wikipedia. (2019). Arsenik. Hämtad från: i.Wikipedia.org
- Doktor. Deg Stewart. (2019). Arsenikelement fakta. Kemikkolis. Återhämtat sig från: Chemicool.com
- Royal Society of Chemistry. (2019). Arsenik. Återhämtat sig från: rsc.Eller
- Redaktörerna för Enyclopaedia Britannica. (3 maj 2019). Arsenik. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- « Egenskaper minoritetsgrupper, typer, exempel
- Reynolds nummer vad är det för, hur det beräknas, övningar »

