Kaliumbensoatstruktur, egenskaper, erhållning, användning
- 3482
- 665
- Anders Svensson
han Kaliumbensoat Det är en organisk förening som bildas av en jonkalium k+ och en bensoato -jon6H5Kuttra-. Dess kemiska formel är c6H5Koka eller kondenserad formel c7H5Ko2. Det är ett kristallint vitt fast ämne. Det är hygroskopiskt, vilket innebär att den absorberar luft från luften.
Kaliumbensoat vattenhaltiga lösningar är något alkaliska. I surt medium bensoatjonen (c6H5Kuttra-) tenderar att ta en proton och bli en bensoesyra (c6H5Cooh).
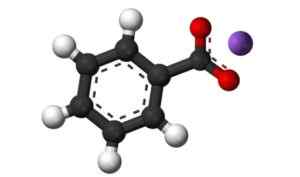
 Kaliumbensoat6H5Fast kock. W. Oelen [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Kaliumbensoat6H5Fast kock. W. Oelen [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Kaliumbensoat används som ett matkonserveringsmedel, särskilt när de önskas vara natriumfria (NA). Förhindrar att mat försämras på grund av mikroorganismer.
Det används i korv, bearbetade läsk och bageri, bland andra livsmedel. Förmodligen beror dess konserveringsmedel på bensoesyra (c6H5COOH) som bildas vid lågt pH, vilket förhindrar reproduktion av svampar och bakterier.
Även om kaliumbensoat är godkänt av hälsoorganisationer är det bekvämt att inte missbruka deras användning, eftersom det har visat sig att mössens foster kan påverka.
[TOC]
Strukturera
Kaliumbensoat är ett organiskt salt, det vill säga ett salt av en karboxylsyra, eftersom det är kaliumsaltet av bensoesyra. Den bildas av en K+ kaliumkatjon och en bensoatanjon c6H5Kuttra-.
Benzoato C -anjonen6H5Kuttra- Den bildas av en bensenisk ring c6H5- och en karboxylat -coo -grupp-.
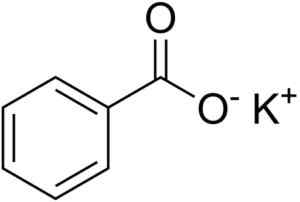 Kemisk struktur av kaliumbensoat. EDGAR181 [Public Domain]. Källa: Wikimedia Commons.
Kemisk struktur av kaliumbensoat. EDGAR181 [Public Domain]. Källa: Wikimedia Commons. Unionen mellan dessa två joner är en stark elektrostatisk förening som håller dem i det kristallina nätverket.
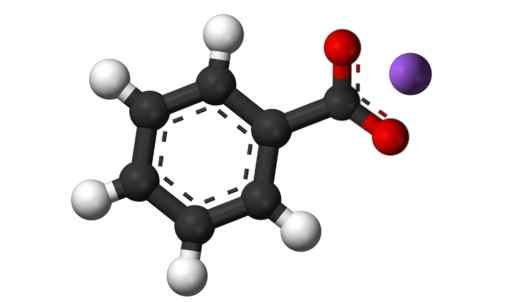
 3D -struktur av kaliumbensoat. Svart = kol; Vit = väte; röd = syre; Violet = kalium. Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
3D -struktur av kaliumbensoat. Svart = kol; Vit = väte; röd = syre; Violet = kalium. Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Nomenklatur
- Kaliumbensoat
- Potasisk bensoesyrasalt
Egenskaper
Fysiskt tillstånd
Kristallint vitt fast ämne.
Molekylvikt
160,212 g/mol
Löslighet
Löslig i vatten.
pH
Kaliumbensoat vattenhaltiga lösningar är något grundläggande.
Kemiska egenskaper
Det är hygroskopiskt, det vill säga det är ett fast ämne som enkelt absorberar vatten från miljön.
Unionen mellan kaliumkjonen+ och bensoato -jonen6H5Kuttra- Liksom i de flesta joniska föreningar kan det bara besegras med en hög temperatur eller med ett mycket polärt lösningsmedel som vatten.
Kan tjäna dig: effektiv kärnbelastningBenzoato C -anjonen6H5Kuttra- Det är måttligt grundläggande, med en märkbar tendens att kombinera med protoner. Reagera med vatten som tar en proton h+ För att bilda bensoesyra (c6H5COOH) och detta leder till en ökning av OH -jonkoncentrationen-.
C6H5Kuttra- + H2Eller ⇔ C6H5COOH + OH-
Av denna anledning är vattenhaltiga kaliumbensoatlösningar något alkaliska.
Erhållande
För att framställa kaliumbensoat neutraliseras bensoesyra (c6H5COOH) med kaliumkarbonat (K2Co3) I en minsta volym vatten för att få en tydlig lösning från vilken salt kristalliserar.
2 c6H5COOH + K2Co3 → 2 C6H5Kuttra-K+ + H2Eller + co2↑
Sedan tvättas det kristalliserade kaliumbensoatsaltet flera gånger med eter och torkar.
Ansökningar
I den bearbetade livsmedelsindustrin
Kaliumbensoat används allmänt som ett antimikrobiellt medel för dryckesbevarande, fruktderivat, bageriprodukter och andra måltider.
 Vissa bageriprodukter kan innehålla kaliumbensoat. Författare: Andrew Martin. Källa: Pixabay.
Vissa bageriprodukter kan innehålla kaliumbensoat. Författare: Andrew Martin. Källa: Pixabay. Det är ett livsmedelskonserveringsmedel som kan hämma, försena eller stoppa processen för jäsning, försurning eller försämring av mat på grund av vissa svampar och bakterier.
Enligt miljöskyddet eller EPA -byrån (akronym för engelska Miljöskyddsbyrå) Kaliumbensoat har verifierats som en förening av liten oro för människors hälsa.
Mot svampar
Det är ett antimikotiskt medel, eftersom det kan förstöra dem genom att undertrycka deras förmåga att växa eller reproducera. Det är inte en fungicid för vävnader i organismen hos djur eller människor, utan en hämmare som försenar eller bromsar framstegen av svampar i mat eller dryck.
Vissa typer av mögel producerar ämnen som kallas aflatoxiner, som är ett hot för både människor och djur eftersom de är giftiga, de kan producera cancer och mutationer.
De flesta formar hämmas i koncentrationer av 0,05-0,10% av kaliumbensoat. Prestandan för detta beror på pH, eftersom mindre pH är mer effektivt som antihongos.
Kan tjäna dig: Kalciumhydroxid (CA (OH) 2): Struktur, egenskaper, erhållning, användning Bearbetade läskedrycker kan innehålla kaliumbensoat. Författare: Lisakara. Källa: Pixabay.
Bearbetade läskedrycker kan innehålla kaliumbensoat. Författare: Lisakara. Källa: Pixabay. Detta beror på att den antimikotiska handlingen i verkligheten ligger i bensoesyran c6H5COOH, som är den konjugerade syran av kaliumbensoat. Denna syra bildas under pH, det vill säga i närvaro av ett stort antal vätejoner h+:
Kaliumbensoat + vätejoner → bensoesyra + kaliumjoner
C6H5Cook + H+ → C6H5COOH + K+
Enligt vissa forskare beror deras effektivitet delvis på lösligheten hos bensoesyra i mikroorganismens cellmembran. Denna typ av syra ökar flödet av protoner genom nämnda membran.
Detta orsakar avbrott eller desorganisering av vissa funktioner i svampcellen.
Mot bakterier
Det är en agent som arbetar mot vissa bakterier. Det läggs till mat som bearbetade korv, bearbetade skinkor (redo att äta) och några drycker.
Har testats mot Listeria monocytogenes, en bakterie som kan orsaka döden av människor som konsumerar mat förorenad med detta. Producerar feber, kräkningar och diarré, bland andra symtom.
Det har visat sig att mat som behandlas med kaliumbensoat och som har förorenats med Listeria De måste hållas vid temperaturer under -2,2 ° C så att sådana bakterier inte reproduceras.
 Korv och annat korvkött kan innehålla kaliumbensoat. Författare: Försäljning av mina foton med aktierna tillåter inte. Källa: Pixabay.
Korv och annat korvkött kan innehålla kaliumbensoat. Författare: Försäljning av mina foton med aktierna tillåter inte. Källa: Pixabay. Å andra sidan har användningen av elektronstrålning testats för att intensifiera effekten av kaliumbensoat mot bakterier, men det har fastställts att bensen C har producerat6H6 vilket är en toxisk förening.
Därför, även om maten innehåller kaliumbensoat.
I flera applikationer
Enligt konsulterade källor används också kaliumbensoat i lim och bindande medel för olika användningsområden. Det läggs till cigaretter och tobak eller är relaterat till tillverkningen av dessa.
Kan tjäna dig: neon: historia, egenskaper, struktur, risker, användningarDet används i personliga vårdprodukter som kosmetika, schampo, parfymer, tvålar, lotioner etc. Det är också en del av målningar och beläggningar.
Negativa effekter på intag av mat med kaliumbensoat
Vissa forskare fann att kaliumbensoat ger skadliga effekter på mössfoster.
Även om det inte fanns några effekter på vuxna möss utsatta för kaliumbensoat.
 Enligt laboratorieupplevelser kan mössfoster påverkas av kaliumbensoat som intas av modern. Författare: Tibor Janosi Mozes. Källa: Pixabay.
Enligt laboratorieupplevelser kan mössfoster påverkas av kaliumbensoat som intas av modern. Författare: Tibor Janosi Mozes. Källa: Pixabay. Detta innebär att fostret är mer känsliga för kaliumbensoat än vuxna möss.
Referenser
- Mandal, s.K. et al. (1978). Viskositetsbeteende hos bensoesyra och bensoatjon i vattenlösning. Journal of Solution Chemistry, Vol. 7, nej. 1, 1978. Länk återhämtat sig.Kandare.com.
- Rusul, g. och Marth, och.H. (1987). Tillväxt och aflatoxinproduktion av Aspergillus parasiticus NRRL 2999 i underhållet av kaliumbnezat eller kaliumsorbat och vid initiala pH -värden. J Food PR. 1987; 50 (10): 820-825. NCBI återhämtade sig.Nlm.Nih.Gov.
- Ljus. et al. (2005). Hämmareffekter av organiska syrasalter för kontroll av Listeria monocytogenes På Frankfurters. J Food PR. 2005; 68 (3): 499-506. NCBI återhämtade sig.Nlm.Nih.Gov.
- Zhu, m.J. et al. (2005). Effekterna av antimikrobiella ingredienser och bestrålning på överlevnaden av Listeria monocytogenes och kvaliteten på klar att-eoat kalkonskinka. Poult Sci. 2005; 84 (4): 613-20. NCBI återhämtade sig.Nlm.Nih.Gov.
- ELLER.S. National Library of Medicine. (2019). Kaliumbensoat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Afshar, m. et al. (2013). Teratogena effekter av lontperioder Konsumtion av kaliumbensoat vid ögonutveckling i BALB/C -fostermöss. Iran J Basic Med Sci. 2013; 16 (4): 584-589. NCBI återhämtade sig.Nlm.Nih.Gov.
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Morrison, r.T. och Boyd, r.N. (2002). Organisk kemi. Sjätte upplagan. Prentice-hall.
- « Administrationens institutionella värden vad de är för, betydelse
- Magnetiska chockenheter, formler, beräkning, exempel »

