Bromo -historia, struktur, elektronisk konfiguration, egenskaper, användningar

- 4473
- 674
- Anders Svensson
han brom Det är ett icke -metalliskt element som tillhör Halogens Group, Group 17 (viia) i det periodiska tabellen. Dess kemiska symbol är BR. Det presenteras som en diatomisk molekyl, vars atomer är förenade med en kovalent bindning, så molekylformeln tilldelas2.
Till skillnad från fluor och klor är brom i markförhållanden inte en gas utan en rödbrun vätska (lägre bild). Det röker, och det är tillsammans med kvicksilver, de enda flytande elementen. Under den kan joden, även om dess färg intensifieras och blir lila, kristallisera i ett flyktigt fast ämne.
 Injektionsflaska med ren flytande brom. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]
Injektionsflaska med ren flytande brom. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] Bromo upptäcktes, självständigt, 1825 av Carl Löwig, som studerade under ledning av den tyska kemisten Leopold Gmelin; Och 1826, av den franska kemisten Antoine-Jerome Ballard. Emellertid föregick publiceringen av de experimentella resultaten från Balard den av Löwig.
Bromo är det 62: e vanligaste elementet på jorden och distribueras i låga koncentrationer av jordens cortex. I havet är den genomsnittliga koncentrationen 65 ppm. Människokroppen innehåller en 0,0004 % brom, inte definitivt att veta sin funktion.
Detta element utnyttjas kommersiellt i Salmuelas eller platser som med speciella förhållanden är höga salter; Till exempel konvergerar Döda havet, till vilket de angränsande territoriernas vatten, mättade med salter.
Det är ett frätande element som kan attackera metaller, såsom platina och paladium. Lönad i vatten kan brom också utöva sin frätande verkan på mänskliga vävnader och förvärra situationen eftersom bromhyterinsyra kan genereras. När det gäller dess toxicitet kan det orsaka viktiga skador på organ, såsom lever, njurar, lunga och mage.
Bromen är mycket skadlig i atmosfären och är 40-100 gånger mer förstörande för ozonskiktet än klor. Hälften av förlusten av ozonskiktet i Antarktis produceras av reaktioner relaterade till bromometyl, förening som används som ett rökmedel.
Det har många användningsområden, till exempel: brandhämmande, blekmedel, ytdesinfektionsmedel, bränsleadditiv, mellanhand i lugnande tillverkning, i tillverkning av organiska kemikalier, etc.
[TOC]
Historia
Carl Löwig arbete
Bromo upptäcktes oberoende och nästan samtidigt av Carl Jacob Löwig, en tysk kemist 1825, och av Antoine Balard, en fransk kemist 1826.
Carl Löwig, en lärjunge av den tyska kemisten Leopold Gmelin, samlade vatten från en vår med dålig kreuznach och tillsatt klor; Efter tillsatsen av etern rörde han blandningen av vätskor.
Sedan, etern separerad genom destillation och koncentrerade den genom indunstning. Som ett resultat fick han ett rödbrunt ämne, som var bromen.
Antoine Balard Work
Balard använde å andra sidan aska av en brun alger. Således släppte Bromo, klor passerade genom det vattenhaltiga materialet som utsattes för extraktion, där magnesiumbromiden, MGBR var närvarande2.
Därefter destillerades materialet i närvaro av mangansdioxid och svavelsyra, vilket producerade röda ångor som kondenserades till en mörk vätska. Balard trodde att det var ett nytt element och kallade honom Muride, härledd från det latinska ordet Muria, med vilket saltlösningen utsågs.
Det kan tjäna dig: levande materia: koncept, egenskaper och exempelDet har påpekats att Balard ändrade namnet på Muride till Brôme genom förslag från Anglada eller Gay-Lussac, baserat på det faktum att Brôme betyder pestilent, som definierar lukten av det upptäckta elementet.
Resultaten publicerades av Belard i Annales of Chemie and Physique, innan Löwig publicerade sin egen.
Endast från 1858 producerades brom i viktiga mängder; år där Stassfurt saltavlagringar upptäcktes och utnyttjades, vilket fick brom.
Elektronisk bromstruktur och konfiguration
Molekyl
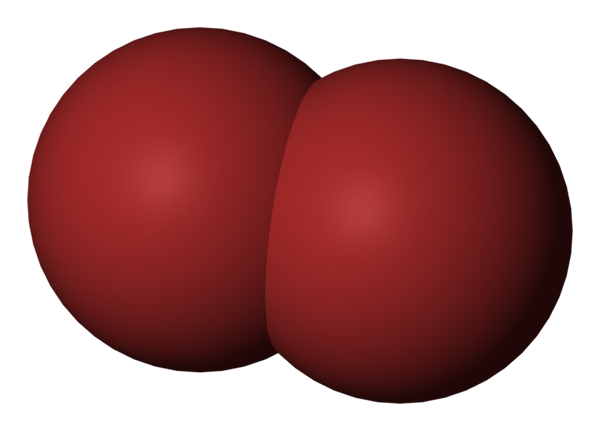 BR2 -molekyl. Källa: Benjah-Bmm27 [Public Domain].
BR2 -molekyl. Källa: Benjah-Bmm27 [Public Domain]. I den övre bilden visas brommolekylen, BR2, Med en kompakt fyllningsmodell. Egentligen finns det en enkel kovalent bindning mellan de två bromatomerna, Br-br-br.
Som en diatomisk och homogen molekyl saknar den permanent dipolmoment och kan bara interagera med andra av samma typ genom London Dispersion Forces.
Detta är anledningen till att din rödaktiga vätska röker; I BR -molekyler2, Medan de är relativt tunga, håller deras intermolekylära krafter dem svagt kopplade.
Bromo är mindre elektronegativ än klor, och utövar därför en lägre attraktionseffekt på elektronerna i Valencia -skikten. Som ett resultat kräver det mindre energi för att resa högre energinivåer, absorbera gröna fotoner och återspeglar en rödaktig färg.
Kristaller
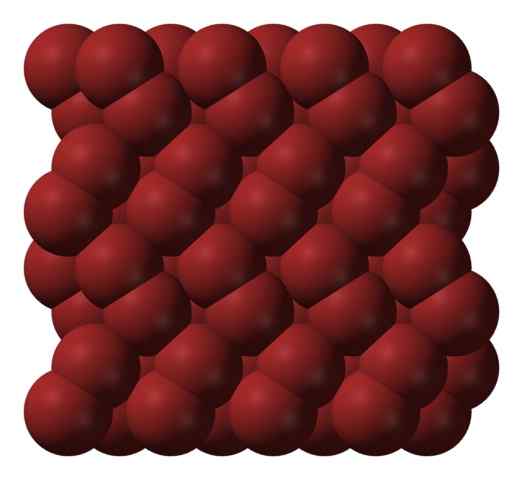 Bromokristallinstruktur. Källa: Ben Mills [Public Domain].
Bromokristallinstruktur. Källa: Ben Mills [Public Domain]. I en gasfas, BR -molekyler2 De separerar avsevärt tills det finns effektiva interaktioner mellan dem. Under dess smältpunkt kan brom emellertid frysas i rödaktiga ortorrombiska kristaller (överlägsen bild).
Observera hur Br -molekyler2 De är ordnade på ett sådant sätt att de verkar "brommaskar". Här och vid dessa temperaturer (T < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valencia -lager och oxidationstillstånd
Den elektroniska bromkonfigurationen är:
[AR] 3D104S2 4p5
Att vara 3D104S2 4p5 dess valenslager (även om 3D -omloppet10 Har inte framträdande i dina kemiska reaktioner). Elektronerna i 4S- och 4P -orbitalerna är de yttersta och lägger till totalt 7, endast en elektron för att slutföra Octet of Valencia.
Från denna konfiguration kan de möjliga oxidationstillstånd härledas för brom: -1, om en elektron får isolektronisk för Kripton; +1, att vara som 3D104S2 4p4; +3, +4 och +5, förlorar alla elektroner i 4p orbital ([AR] 3D104S24p0); och +7, som körs utan elektroner i 4s orbital ([ar] 3D104S04p0).
Egenskaper
Fysiskt utseende
Liten mörkbrun rödaktig vätska. Det finns i naturen som en diatomisk molekyl, med atomer förenade av en kovalent bindning. Bromo är en tätare vätska än vatten och sjunker i den.
Kan tjäna dig: radio: struktur, egenskaper, användningar, erhållaAtomvikt
79 904 g/mol.
Atomnummer
35.
Lukt
En tunnland rök, kvävande och irriterande.
Smältpunkt
-7.2 ºC.
Kokpunkt
58,8 ºC.
Densitet (Br2) flytande
3 1028 g/cm3
Vattenlöslighet
33,6 g/l a 25 ° C. Lösligheten för brom i vatten är låg och tenderar att öka genom att minska temperaturen; beteende som liknar andra gaser.
Lösligheter
Fritt lösligt i alkohol, eter, kloroform, koltetraklorid, koldisulfid och koncentrerad saltsyra. Löslig i icke -polära lösningsmedel och en del polar som alkohol, svavelsyra och i många halogenerade lösningsmedel.
Trippelpunkt
265,9 K vid 5,8 kPa.
Kritisk punkt
588 K vid 10,34 MPa.
Fusionsvärme (BR2)
10,571 kJ/mol.
Förångningsvärme (BR2)
29,96 kJ/mol.
Molär kalorikapacitet (BR2)
75,69 kJ/mol.
Ångtryck
Vid en temperatur av 270 K, 10 kPa.
Självtemperatur
Inte brandfarlig.
antändningspunkt
113 ºC.
Förvaringstemperatur
2 till 8 ºC.
Ytspänning
40,9 mn/m a 25 ºC.
Lukttröskel
0,05 - 3,5 ppm. 0,39 mg/m3
Brytningsindex (ηd)
1 6083 till 20 ºC och 1 6478 till 25 ºC.
Elektronnegativitet
2.96 på Pauling -skalan.
Joniseringsenergi
- Första nivån: 1.139,9 kJ/mol.
- Andra nivå: 2.103 kJ/mol.
- Tredje nivå: 3.470 kJ/mol.
Atomradio
120.
Radiokovalent
120.3.
Van der Waals radio
185.
Reaktivitet
Det är mindre reaktivt än klor, men mer reaktivt än jod. Det är en oxidant mindre stark än klor och starkare än jod. Det är också ett svagare reducerande medel än jod, men starkare än klor.
Klorsång är mycket frätande för många material och mänskliga vävnader. Det attackerar många metallelement, inklusive platina och paladium; Men det attackerar inte bly, nickel, magnesium, järn, zink och under 300 ºC antingen till natrium.
Bromo i vattnet upplever en förändring och förvandlas till bromid. Det kan också existera som en bromat (bro3-), Beroende på vätsket pH.
På grund av dess oxiderande verkan kan brom inducera frisättningen av syrefria radikaler. Dessa är starka oxidanter och kan orsaka vävnadsskador. Brom kan också producera spontan tändning i kombination med kalium, fosfor eller tenn.
Ansökningar
Bensin tillsats
Etylendibromid användes för att eliminera möjliga blyavlagringar i bilarnas motorer. Efter förbränningen av bensin, som använde bly som tillsats, bromin i kombination med bly till formbromid, en flyktig gas som förvisades av avgasröret.
Medan bromen eliminerade ledningen från bensin, var dess destruktiva verkan på ozonskiktet mycket kraftfullt, varför det kasserades för denna applikation.
Bekämpningsmedel
Metylen eller bromometylbromid användes som bekämpningsmedel för att rena jordar, särskilt för att eliminera parasitiska nematoder, såsom AnyLostome.
Användningen av de flesta av föreningarna som innehåller brom har emellertid kasserats återigen förstörande på ozonskiktet.
Kvicksilverutgivningskontroll
Bromo används i vissa växter för att minska kvicksilverutsläpp, mycket giftig metall.
Kan tjäna dig: gravimetri: gravimetrisk analys, metoder, användningar och exempelFotografi
Silverbromid, förutom silver yoduro och silverklorid, används som en ljuskänslig förening i fotografiska emulsioner.
Terapeutiska åtgärder
Kaliumbromid, såväl som litiumbromid, användes som allmänna lugnande medel på 1800 -talet och början av det tjugonde århundradet. Enkla salter används fortfarande i vissa länder som antikonvulsioner.
USA: s FDA godkänner emellertid inte användningen av brom för behandling av någon sjukdom idag.
Brandhoppare
Bromen förvandlas av lågorna till bromhorinsyra, som stör oxidationsreaktionen som inträffar under eld och producerar dess utrotning. Polymerer innehåller brom används för att göra eldfördröjande hartser.
Livsmedelstillsats
Kaliumbromatspår till mjöl har tillsatts för att förbättra matlagningen.
Kemiska reagens och mellanhand
Vätebromid används som reducerande medel och katalysator för organiska reaktioner. Bromo används som en kemisk mellanhand vid tillverkning av läkemedel, hydraulvätskor, kylmedelsmedel, avfuktare och i preparat för att böja håret.
Den finner också användning i utarbetandet av brunnsborrningsvätskor, produkter för vattendesinfektion, vitaktiga medel, ytdesinfektionsmedel, färgämnen, bränsleadditiv, etc.
Biologisk handling
En studie som genomfördes 2014 indikerar att brom är en nödvändig kofaktor för biosyntes av kollagen IV, vilket gör brom till ett viktigt element för djurvävnadsutveckling. Det finns dock ingen information om konsekvenserna av ett underskott av elementet.
Var ligger det
Bromo extraheras kommersiellt från saltgruvor och djupa Salmuelas -brunnar som finns i delstaten Arkansas, och i den stora salta sjön i Utah, båda i USA. Denna sista saltlösning har en 0,5 % bromkoncentration.
För att extrahera brom.
Döda havet, vid gränsen mellan Jordanien och Israel, är ett stängt hav som är under havsnivå, vilket gör det till en mycket hög koncentration av salter.
Bromo och Potassa erhålls kommersiellt där genom förångning av vatten med högt salt av Döda havet. I detta hav kan bromkoncentrationen nå 5 g/L.
Det finns också i höga koncentrationer i vissa varma källor. Bominita är till exempel ett silverbromidmineral som finns i Bolivia och Mexiko.
Risker
Brom i flytande tillstånd är frätande för mänskliga vävnader. Men den största faran för människan kommer från bromångor och inandning.
Andas i en miljö med en bromkoncentration av 11-23 mg/m3 Det ger allvarliga chocker. En koncentration av 30-60 mg/m3 Det är extremt skadligt. Under tiden kan en 200 mg koncentration vara dödlig.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Nationellt centrum för bioteknikinformation. (2019). Brom. Pubchemdatabas. CID = 23968. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Ross Rachel. (8 februari 2017). Fakta om brom. Återhämtat sig från: Livescience.com
- Wikipedia. (2019). Borax. Hämtad från: i.Wikipedia.org
- Lentech B. V. (2019). Brom. Återhämtat sig från: Lentech.com
- « Myosinegenskaper, struktur, typer och funktion
- Nucleas -egenskaper, struktur, typer och funktioner »

