Litiumkarbonat (LI2CO3) struktur, egenskaper, användningar

- 4860
- 460
- Prof. Erik Johansson
han litiumkarbonat Det är ett oorganiskt fast ämne som bildas av två litium Li+ och en karbonatanjon co32-. Dess kemiska formel är li2Co3. Li2Co3 Det är ett vitt kristallint fast ämne som kan erhållas genom reaktionen mellan litiumhydroxid och koldioxid.
Litiumkarbonat har en mycket hög fusionspunkt, så det används vid framställning av glas, keramik och porslin. Det har mycket varierande användningar, såsom laddningsbara litiumbatterier, vid framställning av andra litiumföreningar, svetselektroder och i målningar och lack.
 Litiumkarbonat Li2Co3 fast. Bild taget av W: Användare: Walkerma i juni 2005. Källa: Wikimedia Commons.
Litiumkarbonat Li2Co3 fast. Bild taget av W: Användare: Walkerma i juni 2005. Källa: Wikimedia Commons. Li används också2Co3 I cementblandningar för att uppnå snabb inställning och aluminiumproduktion.
En av dess viktigaste användningsområden är att behandlingen av vissa psykiska sjukdomar som depression och alltför aggressiva beteenden, bland andra förhållanden.
Emellertid måste dess användning som medicin vederbörligen kontrolleras av medicinska specialister eftersom människor behandlade med LI2Co3 De kan drabbas av skadliga effekter för hälsan, såsom hypotyreos (reducerad funktion av sköldkörteln).
[TOC]
Strukturera
Litiumkarbonat består av två litiumli+ och en karbonatanjon co32-.
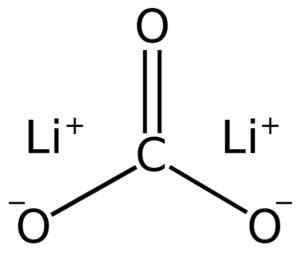 Lii litiumkarbonatstruktur2Co3. Adrian Hands [Public Domain]. Källa: Wikimedia Commons.
Lii litiumkarbonatstruktur2Co3. Adrian Hands [Public Domain]. Källa: Wikimedia Commons. Elektronisk litiumkonfiguration i oxidationstillstånd +1 är 1s2 2s0, Tja, han har tappat elektronen i det sista lagret och är därmed mer stabil. Karbonatjonen32- Den har en platt struktur.
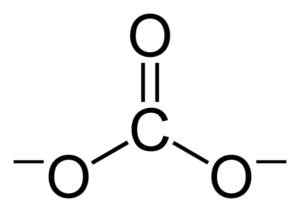 Flat struktur av koljonen Co32-. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Flat struktur av koljonen Co32-. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Negativa belastningar fördelas lika mellan de tre syreatomerna i koljonen CO32-.
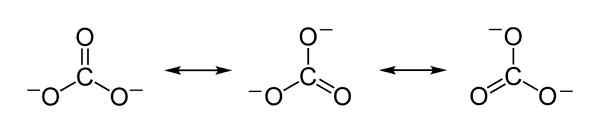 Teoretiska resonansstrukturer för karbonatjon CO32- som tjänar till att förklara en rättvis fördelning av negativa belastningar mellan de 3 syreatomerna. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Teoretiska resonansstrukturer för karbonatjon CO32- som tjänar till att förklara en rättvis fördelning av negativa belastningar mellan de 3 syreatomerna. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
-Litiumkarbonat
-Dilitbarbonat
Fysikaliska egenskaper
Fysiskt tillstånd
Kristallint vitt fast ämne av monoklinisk struktur
Molekylvikt
73,9 g/mol
Smältpunkt
723 ºC
Sönderfall
Det sönderdelas vid 1300 ºC.
Densitet
2,11 g/cm3
Löslighet
Lite lösligt i vatten: 1,31 viktprocent vid 20 ºC. Dess vattenlöslighet minskar när temperaturen ökar. Det är lösligt i utspädda syror. Det är olösligt i alkohol och aceton.
Kan tjäna dig: Bariumoxid (BAO): Struktur, egenskaper, användningar, riskerpH
Vattenlösningar är alkaliska, de har ett pH större än 7.
Kemiska egenskaper
Li2Co3 Det är hydrolyserat i vattenlösning som genererar en grundläggande lösning. Den lilla andelen av föreningen som solubiliseras i vatten lämnar karbonatanjonen32-.
Karbonatanjonen32- Gratis i vattenlösning tar en proton för att bilda HCO -bikarbonatjonen3-, Som framgår av följande reaktion:
Co32- + H2O → HCO3- + Åh-
Närvaron av OH -joner- Det är det som gör lösningen grundläggande.
Biologiska egenskaper
I djur- och mänskliga vävnader finns det normalt litium -jionspår, men tills det ögonblick är ingen naturlig fysiologisk roll för denna jon känd.
I den mänskliga organismen Li2Co3 intaget som medicinering, verkar på olika signalmekanismer i neuroner och andra celler. Detta är resultatet av ersättningen av katjoner som natrium och kalium.
Införlivandet av litiumjonen i cellmembranets struktur kan förändra svaret på hormoner och cellkoppling med energiprocesser.
På detta sätt modifierar litium flera cellulära processer inklusive metabolism.
Genom modifieringen av hur cellerna fungerar2Co3 Du kan agera på kommunikationsmekanismerna för neuroner i hjärnan.
Erhållande
Li2Co3 Det kan erhållas genom litiumhydroxidreaktionen med koldioxid CO2, Enligt nedanstående:
2 lioh + co2 → Li2Co3 + H2ANTINGEN
Kommersiellt förekommer från mineraler som innehåller litium som spodumen och lepidolit. Dessa mineraler behandlas vid höga temperaturer med vissa sulfatsalter eller med alkaliska föreningar för att erhålla litiumsalter.
De erhållna litiumsalterna renas med vatten- eller syralösningar och sedan behandlas de med karbonater för att bilda LI2Co3.
Men li2Co3 uppnås på detta sätt är förorenat med sulfater eller kalciumklorider, magnesium, järn, natrium, kalium, etc. Så kräver efterföljande rening.
Ansökningar
Vid behandling av psykiska sjukdomar
Det används som ett antidepressivt medel, antimansk medel, vid behandling av aggressivt impulsivt beteende och för bipolära störningar (människor som ändrar sin humor plötsligt utan någon orsak, blir våldsam).
Kan tjäna dig: 20 exempel på kemisk sublimering och egenskaper Vissa aggressiva impulsiva störningar kan behandlas med LI2Co3. Författare: Prawny. Källa: Pixabay.
Vissa aggressiva impulsiva störningar kan behandlas med LI2Co3. Författare: Prawny. Källa: Pixabay. Läkare har observerat att deras administration leder till minskningen av intensiteten och frekvensen av allvarliga perioder av depression och maniska avsnitt.
Det används ensamt, det vill säga utan någon tillsatt förening i underhållsterapi av unipolär depression och för schizoekifisk störning. Det tjänar också till att öka den antidepressiva effekten av andra mediciner.
Även om det har använts för att behandla barn med uppenbara symtom på bipolär störning och hyperaktivitet med neurotiska eller aggressiva komponenter, har det inte varit effektivt i alla fall.
Vid behandling av symtom på andra sjukdomar
Det används för att minska frekvensen för stark huvudvärk, återkommande och kronisk.
Det används för att minska förekomsten av infektion hos patienter med kemoterapi inducerad neutropeni eller andra skäl. Neutropeni är minskningen av neutrofiler, en typ av vita blodkroppar som hjälper till att bekämpa infektioner i kroppen.
Det har använts som en sköldkörtelenzyminhibitor för behandling av hypertyreos, men det är inte föredraget behandling på grund av dess negativa effekter.
Administrationsform
Det används i form av Li -tabletter eller kapslar2Co3. Även i långsamma tabletter med litiumcitrat. Li föredras2Co3 Eftersom det inte irriterar halsen när du sväljer den, eftersom det händer med andra litiumsalter.
 Författare: Pete Lyforth. Källa: Pixabay.
Författare: Pete Lyforth. Källa: Pixabay. Negativa effekter
Li2Co3 Det kan ha en skadlig effekt på sköldkörteln och njurarna, så att dessa organens funktion måste övervakas före och under behandlingen med denna förening.
Li2Co3 Det kan vara giftigt vid koncentrationer mycket nära de som är anställda i medicinska behandlingar, så en kontinuerlig granskning av deras blodserumvärden krävs.
Li -förgiftningssymtom2Co3 De är skakningar, muskelspasmer, muskelsvaghet, diarré, kräkningar, dåsighet eller ataxi (försämring av muskelkoordination), bland andra.
I början av lirapi2Co3 Symtom som skakningar, huvudvärk och illamående kan också uppstå. Men dessa tenderar att försvinna genom att fortsätta medicinering.
Kan tjäna dig: HolmioDe flesta behandlade människor kan också utveckla leukocytos (ökning i antalet vita blodkroppar), men detta är reversibelt.
Människor som medicineras med LI2Co3 De bör inte hantera fordon eller använda maskiner, eftersom det minskar fysisk samordning och förmågan att utföra aktiviteter som måste vara vaken.
Fall där det inte ska administreras
Det bör inte användas hos barn under 12 år, eftersom det kan störa bildandet av ben och deras densitet, eftersom det förändrar koncentrationerna av ett sköldkörtelhormon. Det tenderar också att ockupera platsen för kalcium i benen.
De bör inte behandlas med LI2Co3 Människor med hjärt -kärlsjukdomar, njurar eller sköldkörteln. Inte heller hos allvarligt uttorkade patienter.
Gravida kvinnor bör inte administreras särskilt under graviditetens första trimester. Litium korsar moderkakan och kan lätt nå fostret med möjliga teratogena effekter, det vill säga att det kan producera avvikelser eller missbildningar i barnet som brygger.
Äldre människor som behöver behandling med LI2Co3 De bör behandlas med stor omsorg och med doser lägre än för unga vuxna, eftersom de kan utveckla hypotyreos sjukdom.
Andra användningsområden
Li2Co3 Hög renhet används allmänt vid tillverkning av litiumuppladdningsbara batterier.
Det används i smält karbonatbränsleceller.
Det används vid tillverkning av elektriskt porslin som är en typ av elisolerande porslin. Det används också vid produktion av glasering på keramik.
 Li2Co3 Det används för att tillverka elektriskt porslin, som används som elisolator, till exempel i elkraftstolpar. FIR0002 Flagstoffotos [AT] Gmail.com Canon 20d + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.gnu.Org/licenser/gamla licenser/FDL-1.2.html)]. Källa: Wikimedia Commons.
Li2Co3 Det används för att tillverka elektriskt porslin, som används som elisolator, till exempel i elkraftstolpar. FIR0002 Flagstoffotos [AT] Gmail.com Canon 20d + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.gnu.Org/licenser/gamla licenser/FDL-1.2.html)]. Källa: Wikimedia Commons. Det gör det möjligt att förbereda keramik med låg expansionskoefficient, det vill säga att den expanderar mycket lite när man ökar temperaturen, så att keramiken kan användas i ett högre temperaturintervall.
Andra av dess användning är som en katalysator, i tillverkningen av andra litiumföreningar, såsom svetselektroder, i självlysande färgformler, lack och färgämnen, samt i aluminiumelektrolytisk produktion.
Det är användbart för att generera snabbare cementinställning och lägger till kakellim så att de kan fixas på kort tid.
 Författare: capri23auto. Källa: Pixabay.
Författare: capri23auto. Källa: Pixabay. Referenser
- Cai, w. et al. (2018). Borttagning av så42- från LI2Co3 genom omkristallisation i NA2Co3. Kristaller 2018, 8, 19. MDPI återhämtade sig.com.
- Gadikota, g. (2017). Ansluter de morfologiska och kristallstrukturella förändringarna under omvandlingen av litiumhydroxidmonohydrat till litiumkarbonat med hjälp av multi-skala röntgenspridningsmätningar. Mineraler 2017, 7, 169. MDPI återhämtade sig.com.
- ELLER.S. National Library of Medicine. (2019). Litiumkarbonat. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Fjärde upplagan. John Wiley & Sons.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. VCH Verlagsgellschaft MBH.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- « Interna och externa konjugerade vinklar exempel, övningar
- .Stearic Acid (CH3 (CH2) 16COOH) Struktur, egenskaper, användningar »

