Galvaniska celldelar, hur fungerar, applikationer, exempel

- 3912
- 584
- Per Eriksson
De Galvanisk cell O Voltaic Cell är en typ av elektrokemisk cell som består av två olika metaller nedsänkta i två semi -llader, där en förening i aktiv lösning är en spontan reaktion.
Sedan oxideras en av metallerna i en av semi -lladerna medan metallen i den andra semi -media reduceras, vilket producerar ett utbyte av elektroner genom en extern krets. Detta gör det möjligt att dra fördel av elektrisk ström.
 Figur 1. Schema och delar av en galvanisk cell. Källa: Korint.PUCP.Edu.pe.
Figur 1. Schema och delar av en galvanisk cell. Källa: Korint.PUCP.Edu.pe. Namnet på "galvanisk cell" är för att hedra en av pionjärerna i experiment med el: den italienska läkaren och fysiologen Luigi Galvani (1737-1798).
Galvani upptäckte 1780 att om de förenades med ena ändkablar med olika metaller och de fria ändarna sattes i kontakt med ANCA av en groda (död), så inträffade en sammandragning.
Den första som byggde en elektrokemicell som producerade elektricitet var emellertid också den italienska Alessandro Volta (1745-1827) 1800 och därmed det alternativa namnet på Voltaic Cell.
Delar av den galvaniska cellen
Delarna av en galvanisk cell visas i figur 1 och är följande:
1.- Anodisk halvmedia
2.- Anodiumelektrod
3.- Anodisk lösning
4.- Katodisk halvmedia
5.- Katodisk elektrod
6.- Katodisk lösning
7.- Saltlösning
8.- Metallledare
9.- Voltmeter
Fungerande
För att förklara funktionen för en galvanisk cell kommer vi att lita på den nedre:
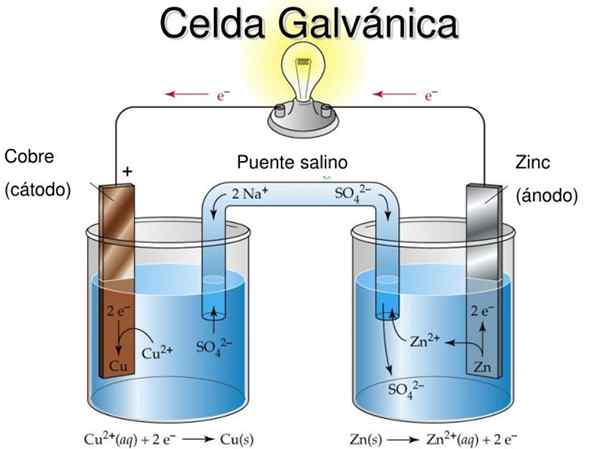 figur 2. Galvanisk celldidaktisk modell. Källa: Slideserve.com
figur 2. Galvanisk celldidaktisk modell. Källa: Slideserve.com Den grundläggande idén med en galvanisk cell är att metallen som lidits av oxidationsreaktionen är fysiskt separerad från metallen som reduceras, så att utbytet av elektroner inträffar genom en extern ledare som gör det möjligt att dra fördel av flödet av elektrisk ström , Till exempel för att tända en glödlampa eller LED.
I figur 2 i semi -media till vänster har du en metallisk kopparband (CU) nedsänkt i en kopparsulfatlösning (CUS04), Medan det i den högra halvlocken finns en zinkband (Zn) nedsänkt i en zinksulfatlösning (ZnSO4).
Det bör noteras att i varje halvmedia finns metallen i var och en i två oxidationstillstånd: de neutrala metallatomerna och metalljonerna i saltet av samma metall i lösning.
Om metallbanden inte är kopplade av en yttre ledande kabel, oxiderar båda metallerna separat i sina respektive celler.
Men när det är elektriskt anslutet kommer oxidation att inträffa i Zn medan det kommer att finnas en reduktionsreaktion på CU. Detta beror på att graden av oxidation av zink är större än koppar.
Metallen som oxiderar ger till metallen som reduceras genom den yttre ledaren och detta strömflöde kan användas.
Kan tjäna dig: halogenerade derivatOxidation och reduktionsreaktioner
Reaktionen som inträffar på höger sida mellan zinkmetallelektroden och den vattenhaltiga zinksulfatlösningen är som följer:
Znantingen(S) + Zn2+ (SW4)2- → 2 Zn2+(Ac) + (SW4)2- + 2 E-
En atom av zink (fast) på ytan av den anodiska elektroden i semi -rätten av höger, stimulerad av de positiva jonerna av zink i lösning, ger två elektroner och kommer ut från elektroden, som går till den vattenhaltiga lösningen Som en positiv dubbel jon av zink.
Vi insåg att nettoresultatet var att en atom av neutral metallzink, genom att förlora två elektroner, blev en jon av zink som bidrar till den vattenhaltiga lösningen, så att zinkstången förlorade en atom och lösningen förvärvade en positiv dubbeljon.
Liberade elektroner föredrar att röra sig genom den yttre kabeln mot metallen i den andra semi -media med positiv belastning (Cartodo +). Zinkstången tappar mässan eftersom dess atomer gradvis passerar till den vattenhaltiga lösningen.
Zinkoxidation kan sammanfattas enligt följande:
Znantingen(S) → Zn2+(Ac) + 2 E-
Reaktionen som inträffar på vänster sida är liknande, men koppar av den vattenhaltiga lösningen fångar två elektroner (kommer från den andra halvtemed) och deponeras i kopparelektroden. När en atom fångar elektroner sägs den reduceras.
Kopparreduktionsreaktionen är skriven så här:
Cu2+(Ac) + 2 E- → CUantingen(S)
Kopparstången får deg, eftersom jonerna i lösningen passerar till stången.
Oxidation sker i anoden (negativ), som avvisar elektroner, medan reduktionen sker i katoden (positiv), som lockar elektroner. Elektronbyte sker genom den externa föraren.
Saltbron
Saltbryggan balanserar de belastningar som ackumuleras i de två halvlyarna. I de anodiska semi -diad -positiva jonerna ackumuleras, medan det i den katodiska finns ett överskott av negativa sulfatjoner.
För saltbron används en lösning av ett salt (såsom natriumklorid eller kaliumklorid) som inte ingriper i reaktionen, som är i ett inverterat U -format rör med ändarna anslutna med en vägg av poröst material.
Det enda syftet med saltbron är att jonerna filtreras till varje cellbalansering eller neutraliserande överskottsbelastning. Således finns det genom saltbron ett strömflöde genom saltjonerna, som stänger den elektriska kretsen.
Oxidations- och reduktionspotentialer
Standard oxidations- och reduktionspotentialer förstås.
Det kan tjäna dig: Skandio: Historia, egenskaper, reaktioner, risker och användningarFör zink är dess standardoxidationspotentialoxe = +0,76 v. Under tiden är standardreduktionspotentialen för koppar ochrutnät = +0,34 v. Elektromotivkraften (FEM) som produceras av denna galvaniska cell är: FEM = +0,76 V + 0,34 V = 1,1 V.
Den globala reaktionen från den galvaniska cellen kan skrivas så här:
Znantingen(S) + Cu2+(Ac) → Zn2+(Ac) + Cuantingen(S)
Med hänsyn till sulfat är nettoreaktionen:
Znantingen(S) + Cu2+ (SW4)2- 25ºC → Zn2+ (SW4)2-+ Cuantingen(S)
Sulfat är en åskådare, medan metaller byter elektroner.
Symbolisk representation av en galvanisk cell
Den galvaniska cellen i figur 2 representeras symboliskt på följande sätt:
Znantingen(S)| Zn2+(Ac) (1m) || Cu2+(Ac) (1m) | Cuantingen(S)
Genom konvention, till vänster är metallen som oxiderar och bildar anoden (-) och separeras med en stapel (|) dess jon i vattenhaltigt tillstånd alltid placeras. Det anodiska halvmediet separeras från den katodiska av två staplar (||) som representerar saltbron. Till höger placeras metallhalvmediet som reduceras och bildar katoden (+).
I den symboliska representationen av en galvanisk cell är slutet alltid den metall som oxiderar och i slutet placeras metallen (i fast tillstånd) som reduceras. Det bör noteras att i figur 2 är semicels omvänt med avseende på konventionell symbolisk representation.
Ansökningar
Känd standardoxidationspotentialer för olika metaller är det möjligt att bestämma den elektromotoriska kraften som kommer att producera en galvanisk hög byggd med dessa metaller.
I det här avsnittet kommer ovanstående att gälla i de föregående avsnitten för att beräkna nätelektromotorskraften hos en cell byggd med andra metaller.
Som ett exempel på applicering överväger vi en galvanisk järncell (tro) och koppar (CU). Som data ges följande reduktionsreaktioner och dess standardreduktionspotential, det vill säga vid 25 ° C och 1M koncentration:
Tro2+(Ac) + 2 E- → Tro(S). E1rutnät = -0,44 v
Cu2+(Ac) + 2 E- → CU(S). E2rutnät = +0,34 v
Det uppmanas att hitta den elektromotoriska nätet som produceras av följande galvaniska cell:
Tro(S)| Tro2+(Ac)(1m) || Cu2+(Ac)| Cu(S)
I denna hög oxiderar järnet och är anoden för den galvaniska cellen, medan koppar reduceras och är katoden. Järnoxidationspotentialen är densamma men i motsats till dess reduktionspotential, det vill säga E1Oxd = +0.44.
För att erhålla den elektromotoriska kraften som produceras av denna galvaniska cell lägger vi till järnoxidationspotentialen med kopparreduktionspotentialen:
Kan tjäna dig: kväveoxider (NOx)fem = e1Oxd + E2rutnät = -E1rutnät + E2rutnät = 0,44 V + 0,34 V = 0,78 V.
Galvanisk cell i det dagliga livet
Galvaniska celler för daglig användning är långt ifrån den form som används som en didaktisk modell, men deras driftsprincip är densamma.
Den vanligaste cellen är 1,5V alkaliskt batteri i sina olika presentationer. Förnamnet kommer eftersom det är en uppsättning celler som är anslutna i serie för att öka FEM.
Uppladdningsbara litiumbatterier är också baserade på samma princip för drift av galvaniska celler och är de som används i smartphones, klockor och andra enheter.
På samma sätt är blybatterierna av bilar, motorcyklar och båtar 12V och baseras på samma princip för drift av den galvaniska cellen.
Galvaniska celler används i estetik och muskelregenerering. Det finns ansiktsbehandlingar som består av att applicera ström av två elektroder i form av en rull eller sfär som rengör och tonifiera huden.
Nuvarande pulser gäller också för att regenerera muskulaturen hos människor som befinner sig i ett framsteg.
Konstruktion av en hemlagad galvanisk cell
Det finns många sätt att bygga en hemlagad galvanisk cell. En av de enklaste är att använda vinäger som en lösning, stålspikar och kopparkablar.
Materiel
-Engångsplastkärl
-vit vinäger
-Två stålskruvar
-Två bitar av naken koppartråd (utan isolering eller lack)
-En voltmeter
Procedur
-Fyll ¾ delar av glaset med vinäger.
-Gå med i de två stålskruvarna med flera trådar och lämna en bit tråd utan att slingra.
Den oändliga änden av kopparkabeln är vikad i en inverterad U -formad.
 Figur 3. Hemlagad galvanisk cell och multimeter. Källa: YouTube.com
Figur 3. Hemlagad galvanisk cell och multimeter. Källa: YouTube.com En annan bit kopparkabel vikas också in i en inverterad och hänger på kanten av glaset i diametralt motsatt läge till de nedsänkta skruvarna, så att en del av koppar är inuti vinäger och den andra delen av kopparkabeln på utsidan av glaset.
De fria ändarna på voltmeterkablarna är anslutna för att mäta den elektromotoriska kraften som produceras av denna enkla cell. FEM för denna typ av cell är 0,5V. För att matcha FEM för ett alkaliskt batteri är det nödvändigt att bygga ytterligare två celler och gå med i de tre i serien, så att ett 1,5V -batteri erhålls
Referenser
- Borneo, r. Galvaniska och elektrolytiska celler. Hämtad från: Quimica -klasser.Bloggfläck.com
- Cedrón, J. Allmän kemi. PUCP. Återhämtat sig från: Korint.PUCP.Edu.pe
- Farrera, L. Introduktion till elektrokemi. UNAM -fysikalisk avdelning. Återhämtat sig från: depa.Fquim.Unk.mx.
- Wikipedia. Elektrokemisk cell. Återhämtad från: är.Wikipedia.com.
- Wikipedia. Galvanisk cell. Återhämtad från: är.Wikipedia.com.

