Sulfanilinsyrastruktur, egenskaper, syntes, användningar
- 3253
- 119
- Johan Eriksson
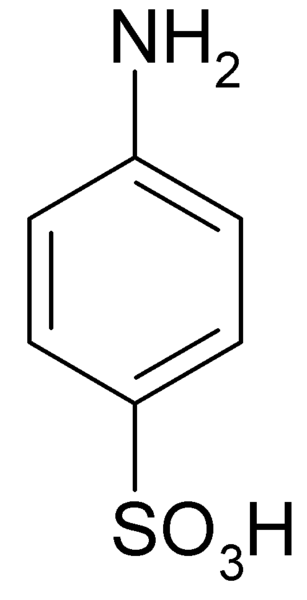
han Sulfansyra Det är en kristallin förening vars molekyl bildas av en bensenring till vilken en basgrupp samtidigt är förenad (-NH2) och en syrogrupp (-SO3H). Dess kemiska formel är NH2C6H4Sw3H.
Det är också känt som 4-aminobencenosulfonsyra. Den är beredd genom sulfonation av anilin i positionen för. Hans kristaller är vita eller vitbund. Dess beteende är mer lik det för ett salt än för en organisk förening med NH -grupper2 Björn3H. Därför är det olösligt i de flesta organiska lösningsmedel.
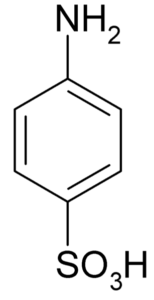 Molekylformel av sulfansyra eller 4-amynobenzeulfonsyra. Klaus Hoffmeier [Public Domain]. Källa: Wikipedia som oss
Molekylformel av sulfansyra eller 4-amynobenzeulfonsyra. Klaus Hoffmeier [Public Domain]. Källa: Wikipedia som oss En av dess huvudsakliga användningsområden är i syntesen av färgämnen, eftersom den lätt bildar en diazokomponerad som är råmaterial för den applikationen.
Både sulfanylsyra och dess derivat har använts som antibakteriella medel. Det används i syntesen av mucolytiska föreningar, eftersom de har förmågan att minska viskositeten hos slem eller mycket viskösa biologiska vätskor.
Det används också i pappersindustrin och i formler för graveringar eller litografier. Det är en del av hartser som används i betongblandningar eller murbruk så att de kan behålla sin flytande under lång tid utan att påverka den slutliga inställningen.
Det är en xenobiotisk metabolit, det betyder att den inte naturligt produceras av levande varelser. Det är irriterande hud, ögon och slem. Dessutom kan du förorena miljön.
[TOC]
Strukturera
Sulfanilsyra har vita kristaller bildade av ortorrombiska eller monokliniska ark. Dess monohydrat kristalliseras i vatten i form av ortorrombiska ark. Om kristallisation görs mycket långsamt, kristalliserar du dihydrat. Monohydratet blir vattenfritt när det är cirka 100 ºC.
Nomenklatur
- Sulfansyra.
- P-amynobencenosulfonsyra.
- 4-amybonzefonsyra.
Egenskaper
Fysiskt tillstånd
Vit eller vitt kristallint fast ämne.
Molekylvikt
173.19 g/mol.
Smältpunkt
Det bryts ner till cirka 288 ºC utan smältning. Det rapporteras också till> 320 ºC.
Densitet
1,49 g/cm3
Löslighet
Nästan olöslig i vatten: 10,68 g/L vid 20 ºC.
Olöslig i etanol, bensen och eter. Något lösligt i het metanol.
Lösliga i vattenhaltiga baslösningar. Olöslig i vattenhaltiga mineralsyralösningar. Löslig i koncentrerad saltsyra.
Kemiska egenskaper
Dess egenskaper skiljer sig från de hos andra amin- eller sulfonerade föreningar, som liknar ett salt. Detta beror på att dess struktur innehåller grupperna -NH3+ Och så3-, Vad som ger det egenskaper för dipoljon.
Kan tjäna dig: Supermatured SolutionDen innehåller en syrogrupp och en basgrupp i motsatta poler av samma molekyl. Men vätejonen är kopplad till kväve istället för syre eftersom gruppen -nH2 Det är en starkare bas än gruppen -så3-.
Eftersom det är en dipoljon presenterar en höjdpunkt av sammanslagning och olöslighet i organiska lösningsmedel.
Sulfanilsyra är löslig i alkalisk lösning eftersom OH hydroxidjon-, Att vara starkt grundläggande börjar en vätejon (h+) av den svaga grundgruppen -nh2, bildar p-aminobencenosulfonatjonen, som är vattenlöslig.
I syralösning förändras inte sulfanylsyrestrukturen, därför förblir den olöslig.
Andra egenskaper
När de värms upp till hans sönderdelning avger giftiga ångor av kväve och svaveloxider.
Sulfanylsyras exponering kan leda till symtom som hudirritation, ögon och slemhinnor. Det är en frätande förening.
Syntes
Den framställs genom att reagera anilin med svavelsyra (h2Sw4) vid höga temperaturer. Ursprungligen bildas det anilinska syrsulfatsaltet, som vid uppvärmning vid 180-200 ºC omorganiseras för att bilda ringen ersätts i position för, eftersom det är den mest stabila produkten.
För att förbereda den med en hög grad av renhet utförs sulfonationen av en blandning av anilin och sulfolano med H2Sw4 vid 180-190 ºC.
Ansökningar
I målarindustrin
Sulfanylsyra används i syntesen eller framställningen av flera färgämnen, såsom metylorange och tartrazin. För detta är det diazotiserat, genererar diazotiserad sulfanylsyra.
Det är viktigt att lyfta fram att tartrazin har använts som färg i maten. Men när den har intagits genererar det vissa metaboliter i den mänskliga organismen, inklusive sulfanylsyra, som är möjliga ansvariga för bildandet av reaktiva syrearter. Dessa kan påverka njurarna (njurar) eller levervävnader (lever).
 Karameller med gult färgämne. David Adam Kess [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikipedia Commons
Karameller med gult färgämne. David Adam Kess [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikipedia Commons I analytisk kemi
Det används som ett reagens i bestämningen av flera kemiska föreningar, inklusive nitriter.
Inom medicin som ett antibakteriellt medel
Sulfanylamid, härrörande från sulfanylsyra, har tillämpning i läkemedelsindustrin eftersom den har antibakteriell aktivitet.
I människokroppen förvirrar bakterier den med p-aminobensoesyra som är en väsentlig metabolit. Denna substitution gör att bakterier inte reproduceras och dör.
Kan tjäna dig: väte: historia, struktur, egenskaper och användningar Bakterie. Raman Oza -bild. Källa: Pixabay
Bakterie. Raman Oza -bild. Källa: Pixabay En annan härrörande från sulfanylsyra, erhållen genom kondens med andra föreningar, har också antibakteriella egenskaper, som är baserade på dess förmåga att förskjuta folsyra (medlem av vitaminkomplexet B).
Denna förening kan tas oralt, injiceras intravenöst eller appliceras externt i en salva.
Inom medicin som ett mukolytiskt medel
Ett sulfanylsyrorivat som har mucolytisk aktivitet har använts. Detta är att den presenterar licuefactiva slemaktivitet, för att lösa upp slemet eller mycket viskösa biologiska vätskor.
Föreningen kan användas för att producera slem som produceras av en vävnad på grund av patologiska förhållanden. Till exempel trängseln av andningsorganen eller den från vaginalkanalen, bland andra.
När det gäller slemvätska i luftvägarna administreras produkten genom inandning, droppar i näsan, dagg, aerosoler eller nebulisatorer. Det är en behandling som är tillämplig på människan eller däggdjur. Det är en kraftfullare förening än cystein baserad.
 Applicering av näsdroppar för kyla. Thorsten Frenzel Image. Källa: Pixabay
Applicering av näsdroppar för kyla. Thorsten Frenzel Image. Källa: Pixabay Det används också i laboratoriet när det önskas att minska viskositeten hos biologiska vätskor för att underlätta analytiska bestämningar.
I bioanalyslaboratorier
Diazotiserad sulfanylsyra (ett derivat som framställs genom att reagera sulfanylsyra med natriumnitrit) används vid bilirubinbestämning.
Bilirubin är ett gult pigment som finns i gallan. Överskottet av blodbilirubin är en följd av leversjukdomar, hematologiska störningar (eller blod) eller störningar i gallvägen.
För att mäta mängden blodbilirubin reageras dialysen härrörande från sulfanylsyra med bilirubin för att bilda Azobilirubin -komplexet, vars färg mäts intensiteten med en kolorimeter eller en spektrofotometer. På detta sätt bestäms blodbilirubininnehållet i blod.
I pappersbranschen
Sulfanilinsyra låter dig syntetisera en papperspolering, det vill säga en förening som ger optisk ljusstyrka eller vitt utseende, eftersom neutraliserar den gula färgen på naturligt eller icke-spårat papper.
 Vitbok anteckningsbok. Källa: Pexels
Vitbok anteckningsbok. Källa: Pexels Det har fördelen jämfört med andra föreningar, eftersom det kan användas i relativt höga koncentrationer för att behandla pappersmassa under lågt pH -förhållanden, utan att öka pappersgult.
Kan tjäna dig: ammoniumsulfatResultatet bevisas när papperet observeras med UV -ljus (ultraviolett), under vilket fluorescerar mycket mer än när andra föreningar används, och med synligt ljus observeras att graden av gulaktighet är mycket låg.
Det är mycket lösligt i vatten, vilket gör att den kan använda i mer koncentrerade lösningar. Det kan användas i alla typer av papper, inklusive papperet som produceras med massa massa, sulfitmassa eller någon annan process.
I intryck, graveringar eller litografier
Sulfanilsyra fungerar som en surande i koncentrerade lösningar för litografi, utan att presentera problemen med andra syror som fosfor, är mindre giftiga och mindre förorenande än det senare än det senare.
I byggmaterial
Vattenhaltig melamin-formaldehydhartslösningar modifierade med sulfanylsyra har testats specifikt (betong), murbruk eller cementpasta. Syftet har varit att minska vatteninnehållet och förhindra minskningen av blandningen av blandningen med tidens gång, utan att inställningstiden minskar.
Den betong eller murbruk som är beredd med dessa lösningar är mycket effektiv på sommaren, när minskningen av flytande över tid utgör ett problem.
Med dessa lösningar, om murbruk eller betong är beredd och av någon anledning måste det vara tillåtet att vila, kan cementkompositionen lätt släppas ut i formar eller liknande, eftersom den inte har tappat flyt över tid.
 Betong urladdning. Igor bild ovsyannykov. Källa: Pixabay
Betong urladdning. Igor bild ovsyannykov. Källa: Pixabay Referenser
- Windholz, m. et al. (redaktörer) (1983). Merck -indexet. En encyklopedi av kemikalier, drarugs och biologiska. Tionde upplagan. Merck & Co., Inkl.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Volym 2. Fjärde upplagan. John Wiley & Sons.
- National Library of Medicine. (2019). Sulfansyra. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Urist, h. och Martin, G.J. (1950). Sulfansyraderivat. US Patent No. 2 504,471. Tilldelare till det nationella läkemedelsföretaget. 18 april 1950.
- Villaume, Frederick G. (1964). Brightcar -komposition för papper som är avtagen från metanilisk och sulfanilinsyra. US Patent No. 3,132,106. 5 maj 1964.
- Martin, Tellis a. och äta, William T. (1979). Bensoesyrarivat och bensensulfonsyrasyra mucolytisk process. US Patent No. 4 132 802. 2 januari 1979.
- Druker, L.J. och Kincaid, r.B. (1979). Litografisk fontänkoncentrat. US Patent No. 4 150,996. 24 april 1979.
- Shull, Bruce C. (1983). Bilibinanalys. US Patent No. 4 404 286. 13 september 1983.
- Uchida, j. et al. (2001). Process för framställning av en vattenlösning av sulfansyramodifierad melamin-formaldehydharts och en cementkomposition. US Patent No. 6 214 965 B1. 10 april 2001.
- Corradini, m.G. (2019). Volym 1. I encyklopedi av livsmedelskemi. Återhämtat sig från Scientedirect.com.
- « Galinsyrastruktur, egenskaper, erhållning, användning
- Svart efter bakgrund, utveckling, åtgärder »

