Strontiumklorid (SRCL2)
- 4265
- 1320
- Johan Olsson
Vad är strontiumklorid?
han Strontiumklorid Det är en oorganisk förening bildad av strontium, alkalinoterreo metall (SR. Becamgbara) och klorhalogen. Eftersom båda elementen har mycket olika elektronegativiteter är föreningen ett joniskt fast ämne vars kemiska formel är SRCL2.
Som ett joniskt fast ämne består det av joner. När det gäller SRCL2, De är en sation2+ För varje två anjoner cl-. Dess egenskaper och tillämpningar liknar kalcium- och bariumklorid.
Som kalciumklorid (CaCl2), är hygroskopisk och dess kristaller absorberar vatten för att bilda hexahydratalt, där sex vattenmolekyler finns i det kristallina gitteret (SRCL2· 6h2ANTINGEN). I själva verket är tillgängligheten av hydratet större än SRCL2 vattenfri (utan vatten).
En av dess huvudsakliga tillämpningar är som en föregångare till andra strontiumföreningar; Det vill säga det utgör källan till strontium i viss kemisk syntes.
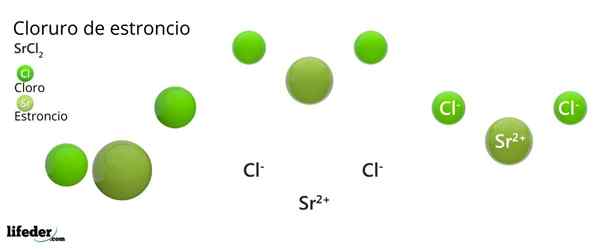
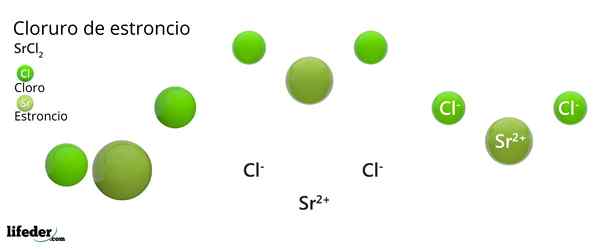
Kemisk struktur av strontiumklorid
 Kristallin struktur av strontiumklorid
Kristallin struktur av strontiumklorid Den överlägsna bilden representerar den kristallina strukturtypen deformerad av SRCL2 vatten-. I detta motsvarar små gröna sfärer srjoner2+, Medan de voluminösa gröna sfärerna representerar Cl -jonerna-.
I denna struktur2+ Det är "fängslad" av åtta Cl -joner-, Följaktligen har ett samordningsnummer lika med 8 och eventuellt en kubisk geometri runt den. Det vill säga fyra gröna sfärer gör taket på kuben, medan de andra fyra golvet, lokaliserade SR2+ I mitten av det.
Vad skulle vara sodafasstrukturen? Lewis struktur för detta salt är CL-SR-Cl, tydligen linjär och antar hundra procent av dess länkar. Men i en gasfas -srcl2(g)- Denna "linje" visar en vinkel på cirka 130 °, och är faktiskt en slags V.
Kan tjäna dig: Gaseous State: Egenskaper, allmän lag, exempelDenna avvikelse kunde inte förklaras framgångsrikt med tanke på det faktum att Strontium inte har delat elektroner som upptar elektronisk volym. Kanske kan det orsakas av deltagande av en orbital d i länkarna eller till en kärnelektronstörning.
Användning/tillämpningar av strontiumklorid
Srcl2· 6h2Eller det har använts som ett tillsatsmedel i organiska polymerer; Till exempel i polyvinylalkohol för att modifiera dess mekaniska och elektriska egenskaper.
Det används som en strontiumferrit vid tillverkning av keramiska och glasmagneter avsedda att göra tv -kristallen.
Reagerar med natriumkromat (NA2CRO4) för att producera strontiumkromat (SRCRO4), som används som korrosionsbeständig färg för aluminium.
När de värms upp med eld lyser strontiumföreningar med en rödaktig låga, varför de är avsedda för utarbetande av blossar och fyrverkerier.
Medicinsk applikationer
Radioisotopen av strontiumklorid 89 (den vanligaste isotopen är 85Herr.
Användningen av utspädda lösningar (3-5 %) i mer än två veckor vid behandling av allergisk rinit (kronisk inflammation i nässlemhinnan) visar förbättringar i minskande nysningar och nässknur.
När den användes i Dentifric Paste -formuleringar för att minska tandkänsligheten och bilda en barriär på dentinala mikrotubuli.
Studier av denna förening visar en terapeutisk effekt jämfört med prednisolon (prednisonläkemedelsmetabolit) vid behandling av ulcerös kolit.
Det kan tjäna dig: Molarfraktion: Hur det beräknas, exempel, övningarResultaten är baserade på råttens modell; Trots detta representerar det hopp för de patienter som också lider av osteoporos, eftersom de kan gå till samma medicinering för att bekämpa de två sjukdomarna.
Det används för att syntetisera strontiumsulfat (SRSO4), ännu mer tätare än SRCL2. Emellertid gör dess minsta vattenlöslighet inte tillräckligt lätt för att appliceras i radiologi, till skillnad från bariumsulfat (BASO4).
Beredning av strontiumklorid
Strontiumklorid kan framställas genom direktverkning av saltsyra (HCL) på ren metall, vilket förekommer en redox -typ reaktion:
MR (S) + HCL (AC) => SRCL2(Ac) + h2(g)
Här oxideras strontiummetallen genom att donera två elektroner för att möjliggöra bildning av gasformigt väte.
Hydroxid- och strontiumkarbonat (SR (OH)2 och srco3) reagera med denna syra genom att syntetisera den:
SR (OH)2(S) + 2HCl (AC) => SRCL2(AC) + 2H2Eller (l)
Srco3(S) + 2HCl (AC) => SRCL2(ac) + co2(g) + h2Eller (l)
Tillämpning av kristallisationstekniker erhålls SRCL2· 6h2ANTINGEN. Efter uttorkad av termisk verkan tills SRCL äntligen produceras2 vatten-.
Strontiumkloridegenskaper
De fysiska och kemiska egenskaperna hos denna förening beror på om den är i dess hydratiserade eller vattenfria form. Detta beror på att elektrostatiska interaktioner förändras när vattenmolekyler läggs till det kristallina gitteret på SRCL2.
Vatten-
Strontiumklorid är ett vitt kristallint fast ämne, med en molekylvikt av 158,53 g/mol och en densitet av 3,05 g/ml.
Dess smältpunkter (874 ºC) och kokning (1250 ºC) är höga, vilket indikerar de starka elektrostatiska interaktioner mellan sr -jonerna2+ och cl-. Det återspeglar också den stora kristallina retikulära energin som dess vattenfria struktur har.
Kan tjäna dig: cellulosacetatSRCL -formation entalpi2 fast ämne är 828,85 kJ/mol. Detta hänvisar till den termiska energin som frigörs av varje mullvad som bildas från dess komponenter i dess standardtillstånd: klor och fast gas för strontium.
Hexahydrat
I form av hexahydrat har den en högre molekylvikt än dess vattenfri (267 g/mol) och en lägre densitet (1,96 g/ml). Denna minskning av dess densitet beror på att vattenmolekylerna "utvidgas" kristallerna och ökar volymen; Därför minskar strukturens densitet.
Det är nästan två gånger tätt än vatten vid rumstemperatur. Dess vattenlöslighet är mycket hög, men i etanol är den något löslig. Detta beror på dess organiska karaktär trots dess polaritet. Det vill säga hexahydrat är en oorganisk polär förening. Slutligen, vid 150 ºC, blir den uttorkad för att producera vattenfritt salt:
Srcl2· 6h2Eller (s) => srcl2(s) + 6h2O (g)
Referenser
- Wikipedia. (2018). Strontiumklorid. Hämtas från.Wikipedia.org
- Drogbank. (2018). Strontiumklorid SR-89. Drugbank återhämtade sig.Växelström
- Pub. (2018). Strontiumklorid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov
- Tjur. Mater. (2010). Påverkan av granulärt stontiumklorid som tillsatser på submmariga elektriska och mekaniska egenskaper för ren polyvinylalkohol. Sci., Vul. 33, nej. 2, sid. 149-155. Indian Academy of Sciences.
- Ccoil. (4 september 2009). Stontium-klorid -xtal-3d-sf. [Figur]. Hämtad 13 april 2018, från: Commons.Wikimedia.org
- Alla reaktioner. SRCL2 - Stontiumklorid. Återhämtat sig från allreaktioner.com