Procentuell koncentration

- 2982
- 123
- Per Eriksson
Vad är den procentuella koncentrationen?
De procentuell koncentration Det är ett sätt att uttrycka förhållandet mellan lösta ämnet i hundra delar av blandningen eller lösningen. Det bör noteras att dessa "delar" kan uttryckas i massa enheter eller volym. Tack vare denna koncentration är sammansättningen av en lösning känd, som till skillnad från en ren förening inte är konstant.
Inte bara dess sammansättning varierar, utan också dess organoleptiska egenskaper. Den nedre bilden te burk får mer intensiva smaker (och färg) eftersom fler kryddor löses i isvatten. Även om deras egenskaper förändras förblir koncentrationen av dessa kryddor konstant.

Om vi antar att 100 gram av dessa löses i vatten och sedan rörs om tillräckligt för att homogenisera lösningen, kommer gramarna att fördelas över burken. Den procentuella koncentrationen av te förblir konstant även om flytande innehåll är uppdelat i olika containrar.
Detta kommer bara att variera om mer vatten läggs till i burken, som, även om den inte modifierar den ursprungliga massan av upplösta kryddor (lösta ämnen), modifierar dess koncentration. För exemplet på tefrekvensen kan denna koncentration uttryckas bekvämt i massan av lösta ämnen mellan vattenvolymen.
Således spelar de oändliga fallen där dessa koncentrationsberäkningar spelar en avgörande roll.
Vad är en lösning?
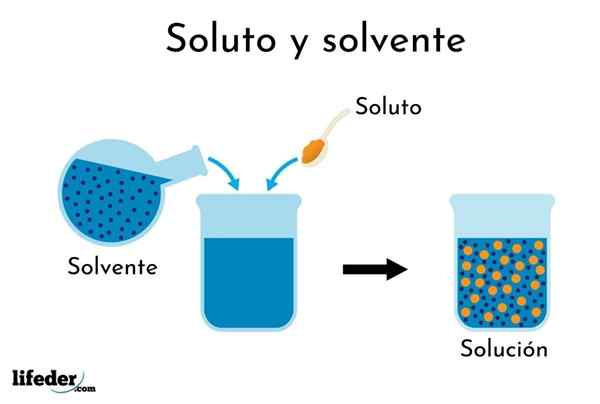 Lösningen upplöses i lösningsmedlet
Lösningen upplöses i lösningsmedlet Förståelsen av termen "lösning" är nödvändig innan man tar upp procentuella uttryck för dess koncentration.
En lösning är en homogen eller enhetlig blandning av två eller flera ämnen vars partiklar är atom- eller molekylstorlek.
Det kan tjäna dig: Vilka är de negativa effekterna vi har med vattenlöslighet?Komponenterna i detta är lösta ämnen och lösningsmedlet. Lösningen är materialet upplöst i en lösning, som är i mindre proportion. Lösningsmedlet är dispersionsmedel i en lösning och är i större andel (såsom vatten i teburk).
Egenskaper för den procentuella koncentrationen
- Den procentuella koncentrationen presenterar komforten att undvika molaritetsberäkningar och andra koncentrationsenheter. I många fall räcker det att veta mängden lösta ämnen som är upplöst i lösningen. Men för kemiska reaktioner lämnar det en sida efter molkoncentration.
- Underlättar verifieringen av massbesparingslagen.
- Det uttrycks i delar per hundra lösning, inom vilken lösta ämnet räknas.
- Förhållandet mellan lösta ämnet och lösningen kan uttryckas i massenheter (gram) eller volym (milliliters).
Hur beräknas det?
Sättet att beräkna det beror på de enheter där du vill uttrycka det. Men den matematiska beräkningen är i huvudsak densamma.
Båda procenten vikt efter vikt % m/m
% (m / m) = (gram löst / gram lösning) ∙ 100
Procentandelen av en lösning indikerar antalet lösta gram i varje 100 gram lösning.
Till exempel innehåller en 10 % m/m -lösning av NaOH 10 gram NaOH per 100 gram lösning. Det kan också tolkas på detta sätt: 10 g NaOH löses i 90 g vatten (100-10).
Båda procentvikten i volym % m/v
% (m / v) = (gram löst / milliliter av lösning) ∙ 100
Kan tjäna dig: kvartära föreningar: egenskaper, träning, exempelProcentandelen i milligram är en koncentrationsenhet som ofta används i kliniska rapporter för att beskriva extremt låga koncentrationer av lösta ämnet (till exempel mineralspår i blodet).
Som ett specifikt fall finns det följande exempel: nivån av kväve i en persons blod är 32 mg%, vilket innebär att det finns 32 mg upplöst kväve per 100 ml blod.
Båda procent volymen i volym % v/v
% (v / v) = (milliliters av lösta ämnen / milliliter av lösning) ∙ 100
Procentvolymen i en lösning av en lösning indikerar antalet milliliter av lösta ämnen i varje 100 milliliters lösning.
Till exempel innehåller en 25%volym/volym av alkohol i vatten, 25 ml alkohol per 100 ml lösning, eller vad som är detsamma: 75 ml vatten löser upp 25 ml alkohol.
Exempel på procentuella koncentrationsberäkningar
Exempel 1
Om de har 7 g Kio3, Hur många gram 0,5 % m/m -lösning kan framställas med denna mängd salt?
En 0,5 % m/m -lösning är mycket utspädd och tolkas enligt följande: För varje 100 gram lösning finns det 0,5 gram Kio3 upplöst. Så för att bestämma gramen för denna lösning som kan förberedas används omvandlingsfaktorer:
7 g kio3 ∙ (100 g sol/ 0.5 g kio3) = 1400 g eller 1.4 kg lösning.
Hur är det möjligt? Uppenbarligen kom den stora mängden massa från vatten; Således, de 7 gram kio3 De upplöstes 1393 gram vatten.
Kan tjäna dig: batchreaktor: egenskaper, delar, applikationerExempel 2
Om du vill förbereda 500 gram av en CUSO -lösning4 1 %, hur många gram bas salt är nödvändiga?
Konverteringsfaktorer tillämpas för att rensa G till CUSO4 Önskad:
500 g Cuso Sun4 ∙ (1 g cuso4/ 100 g Cuso Sun4) = 5 g CUSO4
Det vill säga 5 g cuso upplös4 (en ljus blåaktig färger salt) i 495 g vatten (ungefär 495 ml)
Exempel 3
Om 400 ml vatten är blandade, 37 gram socker, 18 gram salt och 13 gram natriumsulfat (NA2Sw4), Vad är massprocentkoncentrationen för var och en av blandningskomponenterna?
Om det antas att vattentätheten är 1 g/ ml, har blandningen 400 g vatten. Att lägga till den totala massan för lösningskomponenterna är: (400 + 37 + 18 + 13) = 468 g lösning.
Här är beräkningen direkt och enkel:
%Vatten m/ m = (400 g vatten/ 468 g sol) ∙ 100 = 85.47
%Socker m/ m = (37 g socker/ 468 g sol) ∙ 100 = 7.90
%Salt m/ m = (18 g salt/ 468 g sol) ∙ 100 = 3.84
%Na2Sw4 m/m = (13 g na2Sw4/ 468 g sol) ∙ 100 = 2.77
Att lägga till alla individuella massprocent är: (85.47 + 7.90 + 3,84 + 2,77) = 99,98 % ≈ 100 %, den totala blandningen.

