Vad är det mest elektronegativa elementet och varför?

- 2804
- 633
- Prof. Erik Johansson
 Det mest elektronegativa elementet är fluor (F), låst i den röda cirkeln
Det mest elektronegativa elementet är fluor (F), låst i den röda cirkeln han mer elektronegativt element I det periodiska tabellen är det fluor, vars kemikalie är f och tillhör halogruppen. Bland alla elementen i det periodiska tabellen är fluor det mest angelägna att fånga elektroner från andra atomer.
Detta element, gasformigt vid rumstemperatur, är mycket reaktivt och därför är det inte lätt att hitta det i ett rent tillstånd i naturen. Fluor kopplar lätt till andra element som svavel, kalcium och metaller samt många föreningar, särskilt de som innehåller väte.
Dess höga elektronegativitet gör att du till och med kan kombinera med ädla gaser som Xenon, Kripton och Radon.
Efter fluor är syre det andra elementet med den högsta elektronegativiteten. Däremot är elementen med den lägsta elektronegativiteten Francio (FR) och cesium (CS).
 Eftersom det är det mest elektronegativa elementet bildar fluor många föreningar, såsom fluorit eller kalciumfluorid. Källa: Wikimedia Commons
Eftersom det är det mest elektronegativa elementet bildar fluor många föreningar, såsom fluorit eller kalciumfluorid. Källa: Wikimedia Commons Dessa är därför mest elektropositiv Det finns, även om Francio är radioaktivt och mycket lite rikligt i naturen.
Elektronegativitet och periodisk tabell
Skalan av elektronegativitet utvecklades av kemisten och priset Nobel Linus Pauling (1901-1994), även om konceptet beror på den svenska kemisten Jöns Jakob Berzelius (1779-1848).
Pauling -skalan, som tilldelar dimensionella numeriska värden till elektronegativitet, används för att mäta intensiteten med vilken en atom lockar elektron i en annan annan atom och därmed bildar länkar.
Varje element har sin egen elektronegativitet, som beror på dess atomegenskaper. Det bestäms experimentellt och indirekt, till exempel mäta länkenergi, som Pauling gjorde omkring 1932.
På Pauling Electronegativities -skalan är fluor först, med ett ungefärligt värde på 3.98 ≈ 4.0.
Kan tjäna dig: alifatiska kolväten: egenskaper, nomenklatur, reaktioner, typerElektronegativitet är en periodisk egenskap hos elementen. I de flesta fall (det finns några undantag), observeras att elektronegativiteten ökar när man flyttar från vänster till höger genom det periodiska tabellen.
Och också öka från botten upp, genom att gå på en kolumn.
 Den periodiska tabellen över elektronegativiteter enligt Pauling -skalan. Fluor är det mest elektronegativa elementet, beläget ovanför och till höger, medan Francio är det minst elektronegativa av alla, eller det mest elektropositiva, om det föredras, och är i vänster och ner kolumnen. Källa: f. Zapata.
Den periodiska tabellen över elektronegativiteter enligt Pauling -skalan. Fluor är det mest elektronegativa elementet, beläget ovanför och till höger, medan Francio är det minst elektronegativa av alla, eller det mest elektropositiva, om det föredras, och är i vänster och ner kolumnen. Källa: f. Zapata. Fluorelektronegativitet
Anledningen till att fluor är det mest elektronegativa elementet i det periodiska tabellen beror på dess elektroniska konfiguration (hur dess elektroner är ordnade i orbitaler runt kärnan).
Denna konfiguration är 1s22s22 p5, Så fluor har 5 elektroner i sitt yttersta lager.
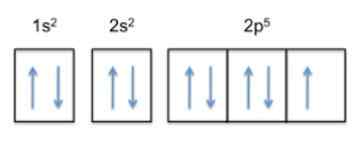
Eftersom atomens trend är att slutföra sitt yttre skikt, betyder det att fluoren kommer att acceptera en elektron av andra atomer med stor lätthet för att få stabilitet och likna den ädla gasen i samma rad, som är neonen , vars elektroniska konfiguration är 1s22s22 p6.
Fluoratomen har en mycket liten radie, eftersom protonerna i deras kärna lockar elektroner mycket starkt och håller dem närmare än i atomerna i mindre elektronegativa element, såsom Cessium och Francio.
Därför är de senare villiga att ge upp elektroner enkelt för att bilda länkar.
Referenser
- Aguilar, c. Guide för den kemiska inlärningsenheten i. Hämtad från: ipn.mx.
- Atkins, s. (2005). Principer för kemi, upptäcktens vägar. 3: e. Utgåva. Pan -American Medical Redaktion.
- Clark, J. Elektronegivitet. Återhämtad från: kem.Librettexts.org.
- Hein, m. (2014). Grunder för högskolekemi. 14: e upplagan. Wiley.
- Lentech. Kemiska element beställda av dess elektronegativitet. Återhämtat sig från: Lentech.är.

