Kemisk bindning
- 4071
- 1277
- PhD. Emil Svensson
Vi förklarar vad de kemiska länkarna är, de typer som finns, och vi ger många exempel
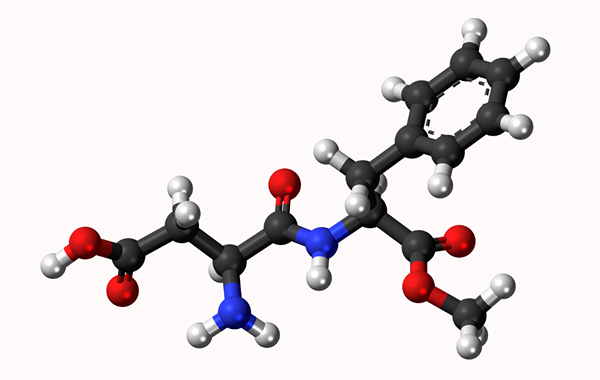
 Aspartamo Molecular Model: Enkel länk representerad av en linje och dubbelbindning med två linjer. Bollarna är atomer
Aspartamo Molecular Model: Enkel länk representerad av en linje och dubbelbindning med två linjer. Bollarna är atomer Vad är en kemisk bindning?
En Kemisk bindning Det är kraften som håller tillsammans med atomerna på en förening. Kraften som förenar atomer är elektromagnetisk, och när atomerna är bundna behåller de sin egen natur.
Till exempel bildas vanligt vatten på grund av föreningen av två väteatomer (h2) och en av syre (O); Det är därför dess kemiska formel är h2ANTINGEN. Även om de är förenade för att bilda vatten förblir väteatomer väte och syre är fortfarande syre.
Kom ihåg att atomer bildas av en kärna omgiven av ett moln av elektroner, som har en negativ belastning. Atomens kärna har en positiv laddning, som lyckas locka elektroner.
Emellertid lockas elektroner också till kärnorna hos andra atomer. Så här bildas kemiska länkar. Det faktum att atomer ger eller delar elektroner genererar de olika typerna av kemiska länkar.
I kemiska bindningar ger atomer, vinner eller delar elektroner av det som kallas Valencia -skiktet, som är det yttersta skiktet i en atom där reaktivitet inträffar eller tendensen att bilda kemiska bindningar.
Dessa länkar gör nya ämnen (inte blandningar) som inte kan separeras genom tekniker som sikt eller filtrering.
Kemiska bindningstyper
Atomer bildas av en kärna (med positiv elektrisk laddning) och elektroner (partiklar med negativ elektrisk laddning) som kretsar kring. Båda parter ingriper i kemiska bindningar.
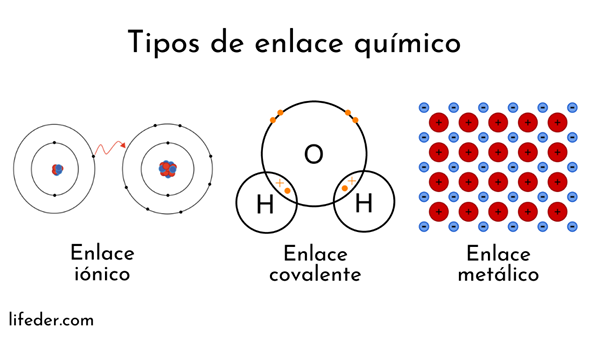
Kemiska bindningar som involverar atomkärnor kallas metalliska. Å andra sidan är de som involverar elektronbyte uppdelade i jon och kovalent.
Kan tjäna dig: klorbensen (C6H5Cl)Jonlänkar
Denna typ av länk är mycket resistent; producerar fasta kemiska föreningar (kristaller) i vattnet och med en hög smältpunkt (mellan 300 och 1.000 grader Celsius). Upplöst i vatten, de är elektricitetsledare.
Hur är joniska länkar?

Jonbindningar förekommer mellan en metall och en icke -metall som har olika elektronegativitet (förmåga att locka elektroner). Elektronerna i Valencia -skiktet i en atom passerar till den andra atomen i Valencia. Vilket är detsamma; En metallatom ger en elektron till en icke -metallisk atom som uppnår elektronisk stabilitet.
Under hela länkbildningsprocessen bildas joner (katjoner och anjoner), därmed det joniska bindningsnamnet.
Ett exempel på denna typ av bindning är natriumklorid: Denna kemiska förening bildas när klor (Cl) lockar elektron i valensskiktet som har natriumatomen (Na).
Ett annat exempel är manganklorid (MGC), som används vid tillverkning av målningar och desinfektionsmedel. Som ett resultat av den kemiska bindningen absorberas elektronerna i manganatomen av kloratomen.
Kovalenta länkar
De kovalenta bindningarna är mycket hårda och genererar olösliga kemiska föreningar med hög fusionstemperatur (mer än 1.000 grader Celsius). De leder inte el.
Enligt hur atomer delar sina elektroner kan kovalenta bindningar vara:
- Enkel: De delar ett par elektroner (A-A).
- Dubbel: Dela två elektronpar (a =).
- Trippel: Dela tre elektronpar (A≡A).
Hur bildas kovalenta bindningar?

Den kovalenta bindningen bildas när två icke -metalliska element delar elektroner i deras valensskikt.
Det kan tjäna dig: Rubidio: Historia, Egenskaper, struktur, erhållning, användningUtbytet av elektroner förekommer alltid på ett sådant sätt att det uppfyller oktetlagen. Detta är en kemisk princip som säger att den mest stabila konfigurationen för en atom är en där den har åtta elektroner i sitt yttersta lager.
Ett exempel på kovalent bindning är vatten (h2ANTINGEN). För att skapa vattenmolekylen behövs två enkla kovalenta bindningar. I en enkel bindning delas väteelektronen med syre, och syre delar en elektron med väte.
Ett annat kovalent bindningsexempel är koldioxid (CO2), en av de viktigaste ansvariga för växthuseffekten och klimatförändringarna. För att bilda denna förening skapar kol och syre två dubbelbindningar, det vill säga för varje länk av elektroner delar.
Metalllänkar
Denna typ av länk sker bara i metallelement. Den består av föreningen mellan kärnorna i två atomer av samma metalliska element tillsammans med deras elektroner.
Metalllänkar kännetecknas av att de är effektiva elektricitetsledare, har en mycket hög fusion och kokpunkt och oxideras lätt. De är också formbara och motståndskraftiga mot repor, mycket solida och starka.
Hur är metalllänkar?
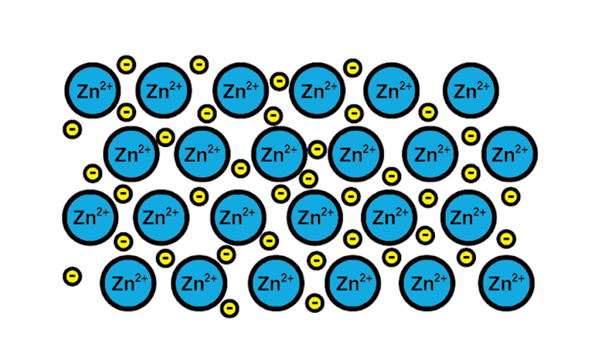 Zinkmetalllänk
Zinkmetalllänk Ett exempel på en metallisk länk är zink, ett metalliskt element. Träningsprocessen för denna typ av länk är:
1-A atomkärna i ett metalliskt element möter en annan kärna av samma element.
2-de elektroner i Valencia-skiktet i båda kärnorna blir ett hav av elektroner runt. Det vill säga att de inte går i en enda atomkärna.
3-de positiva belastningarna av atomkärnorna och elektronernas negativa. Resultatet är valenselektroner som bildar havet av elektroner runt atomkärnorna (katjoner).
Det kan tjäna dig: kopparsulfat (CUSO4): Struktur, egenskaper, erhållning, användningExempel på kemisk bindning
Jonlänkar
- Bariumoxid (Bao).
- Magnesiumklorid (MGCL2).
- Kalciumoxid (CAO)
- Silvernitrat (agno3)
- Zinkhydroxid (Znoh2)
- Kaliumbromid (KBR)
- Kalciumkarbonat (Caco3)
- Kopparsulfat (Cuo4)
- Litiumfluorid (LIF)
- Manganklorid (MNCL2)
- Kaliumsulfat (k2Sw4)
- Järnoxid (ful)
- DISMODIUMFOSFAT (NA2Hpo4)
- Kaliumjoduro (ki)
Kovalenta länkar
- Koldioxid (co2)
- Ammoniak (NH3)
- Paraffin (CNH2N+2)
- Diesel (c12H26)
- Dibromo (Br2)
- Kolmonoxid (CO)
- Butano (c4H10)
- Bensen (c6H6)
- Molekylär kväve (N2)
- Metan (ch4)
- Saltsyra (HCl)
- Cyanhydric Acid (HCN)
Metalllänkar
Varje metall i sitt rena tillstånd är ett exempel på en metallisk länk, nämligen:
- Nickel (NI)
- Järn (tro)
- Aluminium (Al)
- Titan (TI)
- Bly (PB)
- Kobolt (co)
- Koppar (CU)
- Zink (Zn)
- Kvicksilver (Hg)
- Guld (au)
- Silver (AG)
- Barium (BA)
Betydelsen av kemiska bindningar
Vikten av kemiska bindningar är att de bildar organiska och oorganiska molekyler, och på detta sätt är de en del av basen för alla levande organismer. Om de utsätts för vissa villkor kan dessa länkar brytas. Denna energi kallas Länk energi.
Några av teknikerna för att bryta länkarna tillämpas av elektricitet, höga temperaturer eller provocerar kemiska reaktioner med olika föreningar.
Till exempel för att separera syre- och vätemolekyler från h2Eller vi kan applicera elektricitet på vattnet, som är processen som kallas elektrolys.
De kemiska föreningarna som bildas av länken är många och finns i vardagen. Saltet vi använder för att krydda mat är en kemisk sammansatt produkt av länken mellan ett natrium (Na) och en klor (Cl) atom (CL). Dess kemiska formel är NaCl, som läser natriumklorid.

