Uppvärmningskurva Vad är, hur är det, exempel

- 3441
- 151
- Per Eriksson
En Uppvärmningskurva Det är den grafiska representationen av hur temperaturen på ett prov varierar som en funktion av tiden, bibehåller det ständiga trycket och tillsätts värme jämnt, det vill säga med en konstant hastighet.
För att bygga en sådan graf tas par av temperatur och tidsvärden, som därefter graferar temperaturen på den vertikala axeln (beställd) och tiden på den horisontella axeln (Abscissa).
 Figur 1. Värmekurvan för ett ämne erhålls genom att tillsätta värme och mäta temperaturen varje viss tidsintervall. Källa: Pixabay.
Figur 1. Värmekurvan för ett ämne erhålls genom att tillsätta värme och mäta temperaturen varje viss tidsintervall. Källa: Pixabay. Sedan justeras den mest lämpliga kurvan till dessa experimentella punkter och slutligen erhålls en graf över T -temperaturen som en funktion av tiden T: T (T).
[TOC]
Vad är värmekurvan?
När det värms upp går ett ämne genom successivt olika stater: att vara solid kan ånga, nästan alltid går igenom det flytande tillståndet. Dessa processer kallas tillståndsförändringar, där provet ökar sin inre energi samtidigt som det tillsätts värme, vilket indikeras av den molekylära kinetiska teorin.
Genom att lägga till värme till ett prov finns det två möjligheter:
- Ämnet ökar dess temperatur med tanke på att dess partiklar omrörs med större intensitet.
- Materialet går igenom en fasändring, där temperaturen förblir konstant. Tilläggsvärme har effekten av att försvaga i viss utsträckning krafterna som håller partiklarna sammanhängande, så det är lätt att passera från is till flytande vatten, till exempel.
Figur 2 visar de fyra materien: fast, vätska, gas och plasma och namnen på processerna som tillåter övergången mellan varandra. Pilarna indikerar betydelsen av processen.
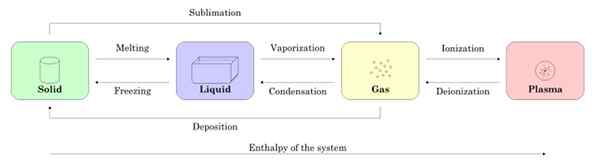 figur 2. Statens tillstånd och processer som krävs för att passera mellan det ena och det andra. Källa: Wikimedia Commons.
figur 2. Statens tillstånd och processer som krävs för att passera mellan det ena och det andra. Källa: Wikimedia Commons. -Statliga förändringar i ett ämne
Börjar med ett prov i fast tillstånd, när smältningen går till flytande tillstånd, när det förångas, blir det gas och genom jonisering blir det plasma.
Det kan tjäna dig: Magnetiska egenskaper hos materialDet fasta ämnet kan direkt bli gas genom processen känd som sublimering. Det finns ämnen som lätt sublimer vid rumstemperatur. Det mest kända är co2 eller torris, liksom naftalen och jod.
Medan provet korsar en tillståndsförändring förblir temperaturen konstant tills det når det nya tillståndet. Detta innebär att om det till exempel finns en del av flytande vatten som har nått sin kokpunkt, förblir temperaturen konstant tills allt vatten har blivit ånga.
Av denna anledning förväntas värmekurvan bestå av en kombination av växande sektioner och horisontella sektioner, där de senare motsvarar fasändringarna. Figur 3 visar en av dessa kurvor för ett givet ämne.
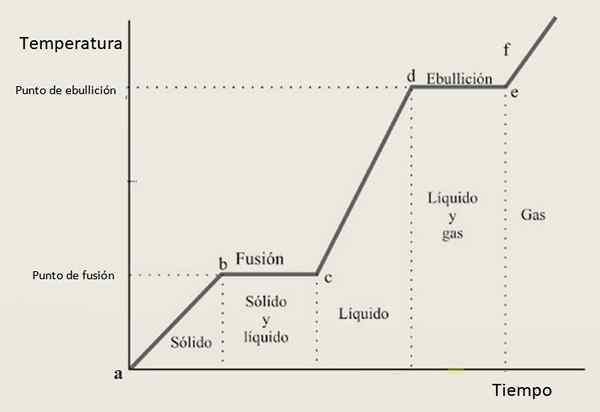 Figur 3. En uppvärmningskurva för ett givet ämne, med den typiska konfigurationen baserad på steg och sluttningar.
Figur 3. En uppvärmningskurva för ett givet ämne, med den typiska konfigurationen baserad på steg och sluttningar. Tolkning av värmekurvan
Inom tillväxtintervall Ab, CD och Ef Ämnet finns som solid, flytande respektive gas. I dessa regioner ökar kinetisk energi och med den temperaturen.
samtidigt i före Kristus Dess tillstånd från fast till vätska förändras, därför samexisterar de två faserna samexisterar. Detta är fallet i avsnittet av, där provet passerar från gasvätska. Här förändrar den potentiella energin och temperaturen förblir konstant.
Det omvända förfarandet är också möjligt, det vill säga provet kan kylas så att det kommer att anta successivt andra stater. I det här fallet talas det om kylkurva.
Uppvärmningskurvor har samma allmänna aspekt för alla ämnen, även om det naturligtvis inte är samma numeriska värden. Vissa ämnen kräver mer tid än andra att ändra tillstånd och smälta och förångas vid olika temperaturer.
Dessa punkter är kända respektive som en smältpunkt och kokpunkt och är egenskaper hos varje substans.
Kan tjäna dig: Flat Mirrors: Ekvation, beteende, grafikDet är därför värmekurvorna är mycket användbara, eftersom de indikerar det numeriska värdet på dessa temperaturer för miljoner ämnen som finns som fasta ämnen och vätskor inom temperaturområdet som anses vara normalt och vid atmosfärstrycket.
Hur görs en värmekurva?
I princip är det mycket enkelt: det räcker för att placera ett prov av substans i en behållare försedd med en omrörare, introducera en termometer och värme jämnt.
Samtidigt aktiveras ett stoppur i början av proceduren och motsvarande temperaturtidspar noteras.
Värmekällan kan vara en gasändare, med god uppvärmningshastighet eller ett elektriskt motstånd som när värme avger värme, som kan ansluta till en variabel källa för att få olika krafter.
För mer precision finns det två tekniker som används i stor utsträckning i kemilaboratoriet:
- Differentiell termisk analys.
- Differentiell svepande kalorimetri.
De jämför temperaturskillnaden mellan provet och ett annat referensprov med hög smälttemperatur, nästan alltid en aluminiumoxid. Dessa metoder försöker enkelt hitta fusions- och kokpunkter.
Exempel (vatten, järn ...)
Tänk på uppvärmningskurvorna för vatten och järn som visas i figuren. Tidsskalan visas inte, men den är omedelbar.
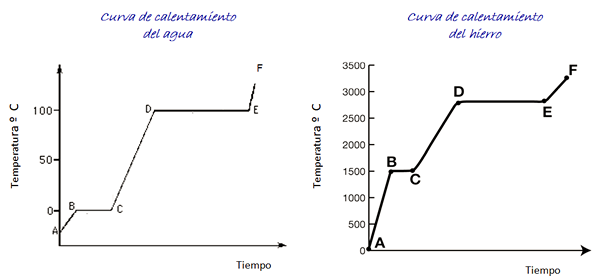 Figur 4. Vatten- och järnvärmekurvor.
Figur 4. Vatten- och järnvärmekurvor. Vatten är ett universellt ämne och det temperaturområde som krävs för att se dess tillstånd är lätt att uppnå i laboratoriet. För järn krävs mycket högre temperaturer, men som anges ovan förändras inte formen på grafen väsentligt väsentligt.
Kan tjäna dig: Steiner Theorem: Förklaring, applikationer, övningarSmältande is
När vi värmer isprovet, enligt grafen är vi vid punkt A, vid en temperatur under 0 ° C. Det observeras att temperaturen ökar med en konstant hastighet tills den når 0 ° C.
Vattenmolekyler inuti isen vibrerar mer bredd. När smälttemperaturen (punkt B) har uppnåtts kan molekylerna redan röra sig framför en annan.
Energin som anländer investeras i att minska attraktionskraften mellan molekylerna, så temperaturen mellan B och C förblir konstant för all is har smälts.
Förvandla vatten till ånga
När vattnet är helt i flytande tillstånd ökar molekylernas vibrationer igen och temperaturen ökar snabbt mellan C och D till kokpunkten med 100 ° C. Mellan D och E förblir temperaturen i det värdet medan energin som anländer är ansvarig för allt vatten i behållaren för att avdunsta.
Om all vattenånga finns i en behållare kan den fortsätta från punkt E till punkt F, vars gräns inte visas i grafiken.
Ett järnprov kan korsa samma förändringar. Men med tanke på materialets natur är temperaturintervallen mycket olika.
Referenser
- Atkins, s. Principer för kemi: upptäcktsvägarna. Pan -American Medical Redaktion. 219-221.
- Chung, s. Uppvärmningskurvor. Återhämtad från: kem.Librettexts.org.
- Uppvärmningskurvor. Fusion och förångning. Återhämtad från: Wikipremed.com.
- Hewitt, Paul. 2012. Konceptuell fysisk vetenskap. Femte. Ed. Pearson. 174-180.
- University of Valladolid. Examen i kemi, återhämtad från: boende.druva.är.
- « Carnot -cykelsteg, applikationer, exempel, övningar
- Bromocresol gröna egenskaper, förberedelser, användningar »

