Skillnader mellan organiska och oorganiska föreningar

- 3952
- 884
- Johan Johansson
De Skillnader mellan organiska och oorganiska föreningar De är inte alltid enkla, och de följer inte heller en oföränderlig regel, för när det gäller kemi finns det symfiner med undantag som motsäger eller ifrågasätter den tidigare kunskapen. Det finns emellertid egenskaper som gör det möjligt att urskilja bland många föreningar som eller inte är oorganiska.
Per definition är organisk kemi studien som inkluderar alla grenar av kolkemi; Därför är det logiskt att tro att deras skelett består av kolatomer. Å andra sidan består vanligtvis oorganiska skelett (utan att komma in i polymerer) av något annat element i det andra periodiska bordet än kol.
Levande varelser, på alla deras skalor och uttryck, är praktiskt taget gjorda av kol och andra heteroátomos (H, O, N, P, S, etc.). Så allt grönska som täcker jordens skorpa, liksom varelserna som går på den, är levande exempel på blandade organiska föreningar komplexa och dynamiskt.
Å andra sidan, borrning av jorden och i bergen hittar vi rika mineralorgan i sammansättning och geometriska former, som i deras stora majoritet är oorganiska föreningar. Det senare definierar också nästan helt atmosfären vi andas och haven, floderna och sjöarna.
Organiska föreningar | Oorganiska föreningar | |
Atomer som komponerar det | De innehåller kolatomer. | De består av andra element än kol. |
De är en del av .. | Är en del av levande varelser. | De är en del av inerta varelser. |
Källor där de är | De är mindre rikliga i naturliga källor. | De är mer rikliga i naturliga källor. |
Typer av föreningar | De är vanligtvis molekylära. | De är vanligtvis joniska. |
Typer av länkar | Kovalenta länkar. | Jonlänkar. |
Molmassor | Större molmassor. | Lägre molmassor. |
Mångfald | De är mindre olika. | De är mer olika element. |
Fusions- och kokpunkter | Mindre fusions- och kokpunkter. | Högre fusions- och kokpunkter. |
Huvudskillnader mellan organiska och oorganiska föreningar
Oorganiska föreningar erhålls från naturliga källor mer rikliga än de för oorganiska föreningar
 Sockerkristaller (höger) och salt (vänster) sett i mikroskop. Källa: Oleg Panichev [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Sockerkristaller (höger) och salt (vänster) sett i mikroskop. Källa: Oleg Panichev [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Även om det kan finnas undantag, erhålls oorganiska föreningar vanligtvis från naturliga källor mer rikliga än för organiska föreningar. Denna första skillnad leder till ett indirekt uttalande: oorganiska föreningar är mer rikliga (på jorden och i kosmos) än organiska föreningar.
Naturligtvis på en oljeplats kommer kolväten och relaterade dominerande att dominera, som är organiska föreningar.
Återvända till avsnittet kan det nämnas på socker-salt som ett exempel. Sockerkristallerna (mer robusta och fasetterade) och salt visas ovan (mindre och rundad).
Sockret erhålls, efter en serie processer, från sockerrörsplantager (i soliga eller tropiska regioner) och sockerbetor (i kalla regioner eller i början av vintrar eller höst). Båda är naturliga och förnybara råvaror, som odlas tills deras korrekta skörd.
Kan tjäna dig: standardisering av lösningarSamtidigt kommer salt från en mycket mer riklig källa: havet, eller sjöar och salter som Halita Mineral (NaCl). Om alla sockerrör och sockerbetor samlades, kunde de aldrig matcha de naturliga saltreserverna.
Oorganiska kristaller är vanligtvis joniska medan organiska kristaller tenderar att vara molekylära
Genom att ta det sockerexala paret igen som ett exempel, vet vi att socker består av en disackarid som kallas sackaros, som i sin tur sönderdelas till en glukosenhet och en annan av fruktos. Sockerkristallerna är molekylära, eftersom de definieras av sackaros och deras intermolekylära vätebroar.
Samtidigt utgör saltkristaller ett na jonnätverk+ och cl-, som definierar en kubisk struktur centrerad på ansikten (FCC).
Den centrala punkten är att oorganiska föreningar vanligtvis bildar joniska kristaller (eller åtminstone har en hög jonisk karaktär). Det finns emellertid flera undantag, till exempel CO -kristaller2, H2S, så2 och andra oorganiska gaser, som stelnar vid låga temperaturer och höga tryck, och är också molekylära.
Vatten representerar det viktigaste undantaget från denna punkt: Ice är en oorganisk och molekylär kristall.
 De få snön eller isen är vattenkristaller, utmärkta exempel på oorganiska molekylära kristaller. Källa: Sieverschar de Pixabay.
De få snön eller isen är vattenkristaller, utmärkta exempel på oorganiska molekylära kristaller. Källa: Sieverschar de Pixabay. Mineraler är i huvudsak oorganiska föreningar, och deras kristaller är därför främst joniska till sin natur. Det är därför denna andra punkt anses giltig för ett brett spektrum av oorganiska föreningar, inklusive salter, sulfider, oxider, telluro, etc.
Den typ av länk som styrs i organiska föreningar är kovalent
Samma socker- och saltkristaller lämnar något fråga: de förstnämnda innehåller kovalenta (riktnings) länkar, medan den senare uppvisar joniska (icke -riktade) länkar (icke -riktande).
Denna punkt är direkt korrelerad med den andra: en molekylkristall måste nödvändigtvis ha flera kovalenta bindningar (som delar ett par elektroner mellan två atomer).
Återigen upprättar organiska salter vissa undantag, eftersom de också har en starkt jonisk karaktär; Till exempel natriumbensoat (c6H5PATA) är ett organiskt salt, men inom bensoat och dess aromatiska ring finns det kovalenta bindningar. Trots det sägs det att deras kristaller är joniska med tanke på den elektrostatiska interaktionen: c6H5Kuttra- Na+.
I organiska föreningar dominerar kovalenta bindningar mellan kolatomer
Eller vad som är detsamma att säga: Organiska föreningar består av kolsyrade skelett. I dem finns det mer än en C-C- eller C-H-bindning, och detta skelett kan vara linjärt, tråkigt eller grenat, varierande i graden av deras omättnad och typen av substituent (heteroaátomos eller funktionella grupper). I socker, C-C, C-H och C-OH-länkar finns i överflöd.
Det kan tjäna dig: reducerande agent: koncept, de starkaste exemplenLåt oss som ett exempel på CO, kap2Ägg2 och h2C2ANTINGEN4. Vilka av dessa tre föreningar är oorganiska?
I ch2Ägg2 (Etylendioxid) Det finns fyra C-H-bindningar och två C-O-länkar, medan i H2C2ANTINGEN4 (oxalsyra) Det finns en C-C, två C-OH och två C = O. Strukturen för H2C2ANTINGEN4 Det kan skrivas som Hooc-Cooh (två länkade karboxylgrupper). Samtidigt består CO av en molekyl som vanligtvis representeras med en hybridbindning mellan C = O och C≡O.
Eftersom i CO (kolmonoxid) finns det bara en kolatom kopplad till en av syre, denna gas är oorganisk; De andra föreningarna är organiska.
Organiska föreningar har vanligtvis större molmassor
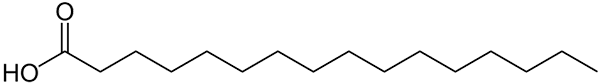 Struktur representerad med palmitinsyralinjer. Det stora som jämförs med mindre oorganiska föreningar, eller formellvikten för dess salter kan märkas. Källa: Wolfgang Schaefer [Public Domain]
Struktur representerad med palmitinsyralinjer. Det stora som jämförs med mindre oorganiska föreningar, eller formellvikten för dess salter kan märkas. Källa: Wolfgang Schaefer [Public Domain] Återigen finns det många undantag från dessa regler, men vanligtvis tenderar organiska föreningar att ha större molmassor på grund av deras kolsyrade skelett.
Till exempel är molarna för ovanstående föreningar: 28 g/mol (CO), 90 g/mol (h2C2ANTINGEN4) och 60 g/mol (välj2Ägg2). Naturligtvis CS2 (Koldisulfid), oorganisk förening och vars molmassa är 76 g/mol, "väger" mer än Cho2Ägg2.
Men hur är det med fetter eller fettsyror? Av biomolekyler såsom DNA eller proteiner? Eller av omfattande linjära kedjekolväten? Eller asfalten? Molmassorna överstiger lätt 100 g/mol. Palmitinsyra (övre bild) har till exempel en 256 g/molmolar deg.
Organiska föreningar är mer rikliga i antal
Vissa oorganiska föreningar, kallade koordinationskomplex, är närvarande isomeía. Detta är emellertid mindre mångsidigt jämfört med organisk isomeria.
Även om vi lägger till alla salter, oxider (metalliska och icke -metalliska), sulfider, telururos, karbider, hydrider, nitrider, etc., Vi skulle inte samla kanske inte ens hälften av de organiska föreningarna som kan existera i naturen. Därför är organiska föreningar mer rikliga i antal och rikare i strukturer.
Oorganiska föreningar är elementära mer olika
Enligt elementär mångfald är oorganiska föreningar emellertid mer varierande. Därför att? För med den periodiska tabellen i handen kan du bygga alla typer av oorganisk förening; Medan en organisk förening endast är begränsad till elementen: c, h, o, p, s, n och x (halogener).
Vi har många metaller (alkaliska, alkaliners, övergång, lantanider, aktinider, de från block P) och oändligheter av alternativ för att kombinera dem med flera anjoner (vanliga oorganiska); som: co32- (Karbonater), Cl- (Klorider), s3- (fosfuros) eller2- (Oxider), OH- (hydroxider), så42- (sulfater), CN- (Cyanides), SCN- (Tiocianates) och många fler.
Observera att CN -anjoner- och SCN- De verkar vara organiska, men de är faktiskt oorganiska. En annan förvirring är oxalatanjonen, c2ANTINGEN42-, vilket är organiskt och icke -inorganiskt.
Kan tjäna dig: diagonal regelOorganiska föreningar har högre fusions- och kokpunkter
Återigen finns det flera undantag från denna regel, eftersom allt beror på vilket par av föreningar som jämförs. Men när de håller sig till oorganiska och organiska salter har den förstnämnda vanligtvis större fusions- och kokpunkter än de senare.
Här hittar vi en annan implicit punkt: Organiska salter är mottagliga för sönderfallande, eftersom värme bryter sina kovalenta bindningar. Trots det jämför vi kalciumtartrat Par (CAC4H4ANTINGEN6) och kalciumkarbonat (Caco3). CAC4H4ANTINGEN6 Det sönderdelas vid 600 ° C, medan Caco3 Den smälter vid 825 ° C.
Och att caco3 är långt ifrån en av salterna med de högsta smältpunkterna, som i CAC: s fall2 (2160 ºC) och CAS2 (2525 ºC): Karuro respektive kalciumsulfid.
Organiska föreningar är mer sällsynta i universum
De enklaste och mest primitiva organiska föreningarna, såsom metan, CHO4, Urea, CO (NH2)2, eller aminosyran glycina, NH2Ch2COOH, är mycket sällsynta arter i kosmos jämfört med ammoniak, koldioxid, titanoxider, kol, etc. I universum upptäcks till och med föregångsmaterialet i livet inte ofta.
Organiska föreningar stöder liv i mycket större grad än oorganiskt
 Skalet av en morrocoy består av en blandning av ben täckta av keratin, som består av en oorganisk matris (hydroxyapatit och relaterade mineraler) och organiska (kollagen, brosk och nerver). Källa: Morrocoy_ (geochelone_carbonary).JPG: Fotografiet.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Skalet av en morrocoy består av en blandning av ben täckta av keratin, som består av en oorganisk matris (hydroxyapatit och relaterade mineraler) och organiska (kollagen, brosk och nerver). Källa: Morrocoy_ (geochelone_carbonary).JPG: Fotografiet.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Kolkemi, organisk, tillämpad i förståelsen av metaboliska processer, blir biokemi (och ur metallkatjonens synvinkel, i bioinorganiska).
Organiska föreningar är hörnstenen i livet (såsom den övre bildens morrocoy), tack vare C-C-länkarna och det enorma konglomeratet av strukturer till följd av dessa länkar och till dess interaktion med kristaller av oorganiska salter.
Återvända till socker-saltparet lever de naturliga sockerkällorna: de är grödor som utvecklas och dör; Men det händer inte samma sak med källorna till saltet: havet eller saltlösningarna lever (i fysiologisk mening).
Växter och djur syntetiserar oändliga organiska föreningar, som integrerar ett omfattande utbud av naturliga produkter (vitaminer, enzymer, hormoner, fetter, färgämnen, etc.).
Vi kan dock inte lämna ut det faktum att vatten är livsmedlet i livet (och är oorganiskt); Inte heller att syre är nödvändigt för cellulär andning (utan att namnge metallkofaktorer, som inte är oorganiska föreningar utan katjoner). Därför spelar oorganisk också en avgörande roll i definitionen av livet.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Helmestine, Anne Marie, PH.D. (3 juli 2019). Skillnaden mellan organisk och oorganisk. Återhämtat sig från: tankco.com
- Texas Education Agency. (2019). Organisk eller oorganisk? Återhämtat sig från: Texasgateway.org
- Sackaros. (s.F.). Hur socker görs: en introduktion. Återhämtat sig från: Sackrosa.com
- Wikipedia. (2019). Lista över oorganiska föreningar. Hämtad från: i.Wikipedia.org
- « Skillnader mellan hastighet och hastighet (med exempel)
- 10 Emotional Intelligence Dynamics för barn och vuxna »

