Stark elektrolytkoncept, egenskaper, exempel

- 4045
- 313
- Karl Johansson
En Stark elektrolyt Det är allt det ämnet som upplöstes i vatten, eller i ett specifikt lösningsmedel, är helt dissocierat på joner. Därför bör det inte finnas en lösning som neutrala molekyler eller som olösliga fasta ämnen. En stark elektrolyt kan vara ett salt, en syra eller en bas, förutsatt att de dissocierar eller helt joniska.
Det mest representativa exemplet på en elektrolyt är vanligt salt, natriumklorid, NaCl. I vattenlösning dissocierar NaCl -kristaller i sin helhet för att producera najoner+ och cl-, Det slutar omgivande vattenmolekyler. Det sägs då att ett salt beter sig som en stark elektrolyt när dess löslighet är mycket hög i vatten.
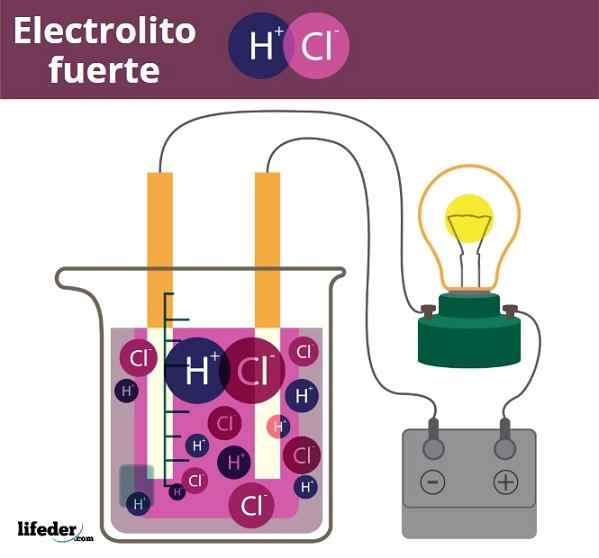 Fuero Electrolite Exempel. HCl, saltsyra, frisläppande H3O+ och Cl -joner-
Fuero Electrolite Exempel. HCl, saltsyra, frisläppande H3O+ och Cl -joner- Något liknande är fallet med syror och baser. När dessa är starka producerar deras lösningar i vatten den maximala möjliga mängden hjoner3ANTINGEN+ eller åh-, Så pH -förändringar är plötsliga. Exempel på starka syror och baser är salpetersyra, HNO3, respektive kaliumhydroxid, KOH.
Det är viktigt att veta hur man identifierar starka elektrolyter när man förbereder mycket joniska lösningar, eller mycket stark syra eller grundläggande medel.
[TOC]
Egenskaper hos starka elektrolyter
Löslighet
Starka elektrolyter kännetecknas av att vara extremt lösliga vattenämnen. Oavsett om det är fasta eller gaser, när det kommer i kontakt med vatten, bör det inte försenas för mycket för att lösa upp helt. Om ett salt, till exempel, är lite lösligt i vatten, kan kasseras som en stark elektrolyt.
Jonkonduktivitet
Starka elektrolyter är inte bara mycket lösliga i vatten, utan genererar också ett stort antal joner. Tack vare de elektriska laddningarna för dessa joner kan elektroner bekvämt resa lösningarna. Detta återspeglas i en ökning av jonkonduktiviteten med avseende på rent vatten. Det är därför joniska lösningar leder mycket bra el.
Kan tjäna dig: klor: historia, egenskaper, struktur, risker, användningarSaltlösning
Många saltlösningar starka elektrolyter, när de löses i vatten, ger inte någon pH -förändring. Detta innebär att lösningarna för dessa salter inte är sura eller grundläggande, utan neutrala, med ett pH nära 7.
Det kan emellertid finnas syra eller basiska salter som lätt löses i vatten, och som också genererar kompletta joner. Till exempel natriumkarbonat2Co3, upplöses för att generera najoner+ och co32-, Men lösningens pH är grundläggande.
Exempel på starka elektrolyter
 Natriumklorid är det mest representativa exemplet på en stark elektrolyt. Källa: Cristian V. /CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)
Natriumklorid är det mest representativa exemplet på en stark elektrolyt. Källa: Cristian V. /CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0) Starka elektrolyter, som är så många, är indelade i tre klassificeringar: starka syror, starka baser och lösliga salterprodukt av neutralisering mellan de två första.
Starka syror
Starka syror vid upplösning i vatten, utan problem, måste producera maximal möjlig mängd h3ANTINGEN+, Så syra måste vara helt jon; det vill säga det bör inte existera som en neutral molekyl med syraprotoner utan att frigöra.
Exempel på dessa syror är:
-HCl, saltsyra, frigör hjoner3ANTINGEN+ och cl-
-HF, fluorhorinsyra, frigör hjoner3ANTINGEN+ och f-
-Hno3, Salpetersyra, frisläppande hones h3ANTINGEN+ och inte3-
-Hclo4, percloric acid, frigör hjoner3ANTINGEN+ och clo4-
-Hio4, Periódic acid, frigör hjoner3ANTINGEN+ och io4-
-H2Sw4, svavelsyra, frigör hones h3ANTINGEN+ Och så42-
Anledningen till att hydriumjonen, h3ANTINGEN+, Det är alltid närvarande (på ett eller annat sätt), det beror på att väte som de donerar mottas av en vattenmolekyl:
HCL + H2O → h3ANTINGEN+ + Kli-
Reaktionen är direkt och irreversibel. Detta är ett kännetecken för en stark syra, som i sin tur är en stark elektrolyt på grund av dess fulla jonisering i vatten.
Kan tjäna dig: alifatiska kolväten: egenskaper, nomenklatur, reaktioner, typerStarka baser
Starka baser, upplösning i vatten utan problem, måste frigöra OH -joner- från samma kristaller, eller irreversibelt obegränsad vattenmolekyl för att generera dem.
Många starka baser består av jon och icke -molekylära fasta ämnen. Några exempel på dessa baser som uppför sig som starka elektrolyter är:
-LIOH, litiumhydroxid, släpper OH -joner- och li+
-NaOH, natriumhydroxid, släpper OH -joner- och na+
-RBOH, Rubidio Hydroxide, släpper OH -joner- och RB+
-Ca (oh)2, Kalciumhydroxid, släpp OH -joner- och ca2+
-SR (OH)2, Strontium hydroxid, släpp OH -joner- och herr2+
-BA (OH)2, Bariumhydroxid, släpp OH -joner- och BA2+
-NAH, natriumhydrid, släpper OH -joner- och vätgas, h2
-Nanh2, Natrium amiduro, släpp OH -joner- och ammoniakgas, NH3
Du går ut
Hallobasi starka elektrolyter vid upplösning i vatten måste vara helt jon. Många av dem producerar inte pH -förändringar. Detta beror på att deras joner är mycket stabila, så de deltar inte i hydrolysbalanser för att förändra vattenens natur. Exempel på dessa salter är:
-NaCl, natriumklorid, frigör Na -joner+ och cl-
-Agno3, Silvernitrat, frisläppande AG -joner+ och inte3-
-Äldre bror3, Natriumnitrat, släpp najoner+ och inte3-
-K2Sw4, Kaliumsulfat, frigör kjoner+ Och så42-
-Mgcl2, Magnesiumklorid frigör mgjoner2+ och cl-
-Cuso4, Kuprisk sulfat, frigör joner CU2+ Och så42-
-KBR, kaliumbromid, frigör K -joner+ och br-
-Nh4Cl, ammoniumklorid, frigör NH -joner4+, Kli-, H3ANTINGEN+ och ammoniakgas
Det kan tjäna dig: kvicksilverklorid (ii): struktur, egenskaper, erhållning, användningar-NACN, natriumcyanid, frigör Na -joner+ och CN-
-Na3Po4, Natriumfosfat frigör Na -joner+ och po43-
-Crcl3, Kromisk klorid frigör CR -joner3+ och cl-
-Aub3, Auric bromid släpper aujoner3+ och br-
-SNSO4, Estany Sulfate, släpper SN -joner2+ Och så42-
Nh4CL är ett motsägelsefullt exempel: det är helt joniserat, men samtidigt genererar den ammoniakneutrala molekyler eftersom det är ett surt salt.
Skillnader mellan stark och svag elektrolyt
Även om skillnaderna mellan en stark elektrolyt av en svag har fastställts indirekt, kommer dessa att presenteras nedan som en slutsats:
-Starka elektrolyter är mycket lösliga i vatten; Svaga elektrolyter är det inte.
-Joniseringen av en svag elektrolyt är partiell, vilket innebär att det kan finnas neutrala molekyler i lösning. Istället finns starka elektrolyter uteslutande som joner.
-De svaga syrorna och baserna, som i sin tur är svaga elektrolyter, dissocierar sig inte helt i vatten, så de genererar mindre joner h3ANTINGEN+ eller åh- Vad som kan förväntas.
-Halt -halin starka elektrolyter är nästan inte hydrolyserade jämfört med svaga elektrolyter. Därför tenderar de förstnämnda lösningarna att vara neutrala, utom när de hanterar syra eller grundsalter.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Stark elektrolyt. Hämtad från: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 februari 2020). Stark elektrolytdefinition och exempel. Återhämtat sig från: tankco.com
- Chung & Chieh. (5 juni 2019). Elektrolyter. Kemi librettexts. Återhämtad från: kem.Librettexts.org

