Vätskevaporbalans

- 3942
- 72
- Johan Gustafsson
Vad är flytande-veterbalans?
han vätskevaporbalans Det är ett dynamiskt tillstånd som skapar en vätska, vare sig det är ett rent ämne eller en blandning, med ångan som omger och interagerar med ytan. Att äga rum måste behållaren vara stängd, annars skulle luftströmmarna få vätskan att avdunsta långsamt.
När systemet är stängt kommer trycket som utövas av ångfasmolekyler att klättra när tiden går. En punkt kommer där trycket kommer att stoppa; Detta är vätskans ångtryck, som är en fysisk egenskap i saken, som är oberoende av behållarens storlek eller vätskevolym.
 När en gasdryck upptäcks störs dess vätskevaporbalans, vilket orsakar en obalans av trycket utanför och inuti flaskan, och med den bubben. Källa: OpenStax, CC av 4.0, via Wikimedia Commons
När en gasdryck upptäcks störs dess vätskevaporbalans, vilket orsakar en obalans av trycket utanför och inuti flaskan, och med den bubben. Källa: OpenStax, CC av 4.0, via Wikimedia Commons Varje vätska, ren eller blandad kommer att ha ett tillhörande ångtryck som kommer att bero på volatiliteten hos dess komponenter; Och därför av de intermolekylära krafterna som håller dem ihop i vätskan och på deras yta.
Detta tryck kan beskrivas genom att anta lösningarnas idealitet eller blandbarhet hos komponenterna i en blandning. För att göra detta är användningen av binära diagram mycket användbar, där det är möjligt att fundera över en separationsprocesss livskraft.
Vätskevapornsjämvikten är avgörande för oändligheter i kemitekniska processer, såsom fraktionella destillationer och de som är gjorda med vattenånga, genom vilka destillerad destillerad i de mest flyktiga komponenterna erhålls. Detta är fallet med etanol vid 95.4% i vatten och är den mest tillgängliga och ekonomiska alkoholprocenten på marknaden.
Ren substans
Molekylerna i ett rent ämne är inte stilla, men flyttar från en plats till en annan tack vare en inre kinetisk energi. Denna energi kan ibland vara tillräckligt stor för att övervinna de intermolekylära krafterna som "drar" en molekyl från speciellt till vätskans barm. Sedan kommer molekylen att fly från vätskans yta till ångfasen.
I ångfasen kommer molekylerna att kollidera med de inre väggarna i behållaren, vinna eller förlora hastigheten tills de återförenas med vätskans yta, där de en gång går för att integrera konglomeratet av molekyler i vätskefasen.
Kan tjäna dig: kobolt: struktur, egenskaper, applikationerSåledes går tiden tills, vid en viss temperatur (för att säga 25 ° C), antalet molekyler som undviker ytan är lika med de som kommer in från ånga. Det sägs därför att en vätskevaporbalans har etablerats i ett rent ämne till.
Ångtrycket för att uppleva de inre väggarna i behållaren, såväl som vätskans yta, kommer att vara lika med PTILLº, som är konstant och reproducerbar; Oavsett hur stor eller liten behållaren är eller vätskans volym som övervägs.
Blandningar
I flytande blandningar kommer det också att finnas en komponent som utövar tryck på vätskan och behållarkonturerna. Ditt ångtryck, som man kan förvänta sig, kommer att bestå av bidrag från var och en av komponenterna i blandningen, för att säga, två ämnen A och B. Dessa blandningar kan vara blandbara, delvis blandbara.
Blandbar
I en blandbar blandning mellan A och B utgör båda ämnena en enda fas, som vid första anblicken ser ut som ett rent ämne. Enligt Daltons lag kommer således blandningen eller lösningen att vara lika med:
PSol = PTILL + PB +··· pYo
Vara pYo någon annan komponent som också finns i blandningen. Observera att sTILL≠ pTILLº, det vill säga trycket från ämnena i blandningen är inte samma som de i deras höga renhetstillstånd.
När man antar att lösningen är idealisk är skillnaderna mellan interaktioner A-A, B-B och A-B uppenbara. Detta kan till exempel appliceras i en blandning av etanol och metanol.
Därför kommer ångtrycket för komponenterna i blandningen att bero på deras relativa mängder i vätskefasen, uttryckta som molära fraktioner xYo. Och det är här Raaults lag ingriper, som försöker relatera trycket pTILL Och sTILLº:
PTILL = XTILL PTILLº
Att nu vara det totala trycket som är lika med:
PSol = XTILL PTILLº + xB PBº +···
Ångfasen, å andra sidan, kommer att ha sina egna kompositioner, uttryckta som YI -molära fraktioner:
Yi = pYo / PSol
= XYo PYoº / pSol
Binärdiagram
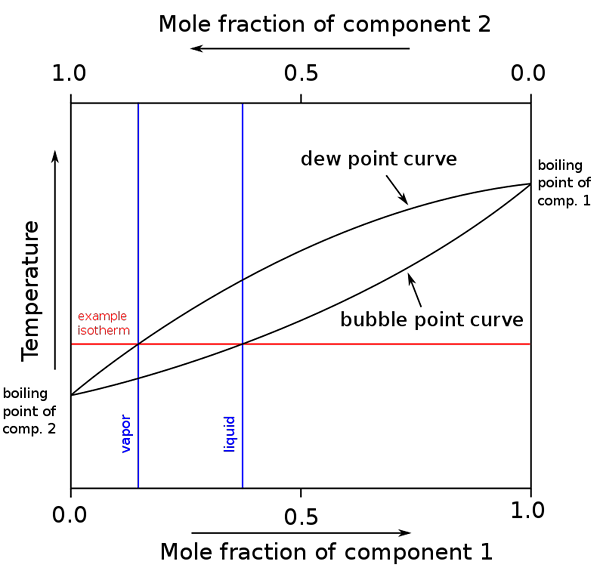 Diagram över kokpunkter och molkompositioner för en binär blandning. Källa: binary_boiling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC BY-SA 2.5, via Wikimedia Commons
Diagram över kokpunkter och molkompositioner för en binär blandning. Källa: binary_boiling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC BY-SA 2.5, via Wikimedia Commons När de molära fraktionerna av komponenterna i en binär blandning (a + b) är grafiska, beroende på temperatur eller tryck, erhålls binära diagram (se ovan). Denna speciella form, den enklaste, motsvarar den för ideala lösningar.
Kan tjäna dig: molvolym: koncept och formel, beräkning och exempelOmrådet ovanför "ovalen" motsvarar ångfasen, medan området nedan motsvarar blandningens flytande fas. Observera att när den molära fraktionen av komponent 1 eller är 0 (x1= 0), den molära fraktionen av komponent 2 eller B kommer att vara lika med 1 (x2= 1), och sedan är ångtrycket bara skyldig b. Denna temperatur blir kokpunkten för B.
Under tiden, i andra änden (höger), när x2= 0 men x1= 1, ångtrycket är bara. Denna temperatur blir den för dess kokpunkt.
Den nedre ovala linjen motsvarar bubbelpunkten, vilket är när den första bubblan dyker upp när den flytande blandningen värms upp (går upp i diagrammet). Och den övre linjen motsvarar daggpunkten, vilket är när ångfasen svalnar och den första droppen dyker upp (går ner i diagrammet).
Azeotropos
I många icke -idealiska lösningar kommer vi att ha azeotrops, som är blandningar som avdunstar att bibehålla deras sammansättningskonstant; det vill säga de förångas som om de var en ren förening.
Det är omöjligt att "bryta" en azeotropisk komposition genom mer destillationssteg. Istället används andra metoder för att öka renheten på den önskade komponenten.
Till exempel bildar etanol-vattenblandningen en azeotropik med en 95-komposition.4 av etanol. Detta innebär att det är omöjligt, genom destillationer, att erhålla en etanol med en koncentration större än 95.4%; Det kommer alltid att finnas 4.6% kvarvarande vatten. Om du ville förbereda absolut etanol (100%) skulle det krävas att använda dehydratiseringsmaterial eller andra syntesvägar.
I ett binärt diagram kan vi se närvaron av en azeotrop, som presenterar följande form:
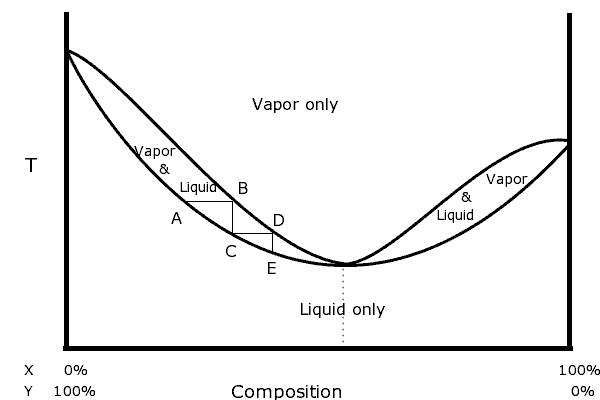 Binärt diagram över en blandning med positiv azeotropisk. Källa: Karlhahn på engelska Wikipedia, allmän domän, via Wikimedia Common
Binärt diagram över en blandning med positiv azeotropisk. Källa: Karlhahn på engelska Wikipedia, allmän domän, via Wikimedia Common Till vänster om diagrammet kan man se att vi inom "Oval", en region där vi har vätskevaporbalansen, kan destillera i på varandra följande steg (A, B, C, D och E) för att få en allt mer rik Blandning i den mest flyktiga komponenten (x för detta diagram).
I azeotropisk punkt är emellertid X och Y och Y och Boil -blandningen som om det var ett enda ämne, så det spelar ingen roll hur många destillationer som görs, både vätskan och ångan kommer att ha samma komposition.
Kan tjäna dig: Molekylär formel: Hur man får ut det, exempel och övningarDelvis blandbar
I de delvis blandbara blandningarna kommer de att bildas, beroende på temperaturen, två igenkännbara faser: en rik på komponent A och en annan rik på komponent B. De binära diagrammen för dessa fall är många strängare och breda, eftersom de involverar regioner där ångan samexisterar tillsammans med de två faserna.
Smittbar
När man talar om oblandbara blandningar kommer varje komponent att bete sig som om den var i ett tillstånd av hög renhet, eftersom den knappt interagerar med de andra molekylerna. Därför kommer ångtrycket för dessa blandningar att vara lika med:
PSol = PTILLº + pBº +··· pYoº
Blandningen kommer att koka vid en temperatur som är lägre än för rena komponenter, eftersom trycket från den oblandbara blandningen kommer att vara högre, eftersom det är lika med summan av trycket för varje komponent i dess rena tillstånd. Mer ångtryck innebär att det är mer flyktigt och därför kommer att koka vid en lägre temperatur.
Ansökningar
Destillationer
I destillationer, särskilt på industriell nivå, är kunskapen om flytande avluftbalans primär. Från komponenterna i blandningen och dess fasdiagram kan det beräknas hur många rätter som behövs vid konstruktionen av ett fraktionstorn för rätt separering av nämnda komponenter.
Vattenånga destillation
Vattenånga kan pumpas inuti en blandning under destillation. När du bubblar vattenånga inuti vätskan kommer blandningens ångtryck att ökas, så det kommer att koka vid en lägre temperatur och hjälpa till att extrahera de mest flyktiga komponenterna (som essenser).
Dricksfågel
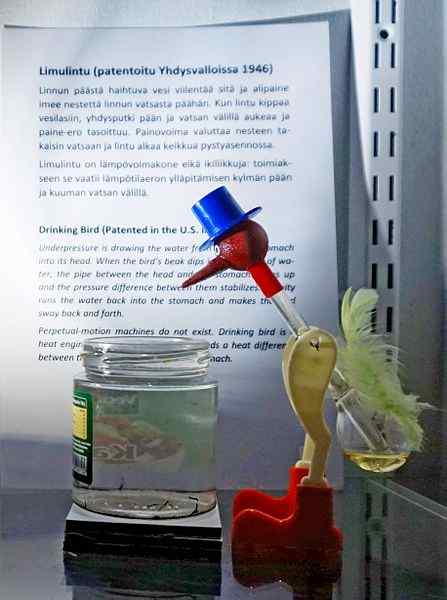 Dricker Bird, en av de mest geniala leksakerna genom tiderna. Källa: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons
Dricker Bird, en av de mest geniala leksakerna genom tiderna. Källa: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons Även om det inte är exakt en vätskevaporjämvikt, är sanningen att bakom driftsfågelns drift är flera termodynamiska fenomen dolda.
När fågelns huvud är vått börjar det svalna när vattnet förångas. Denna temperaturminskning orsakar en minskning av trycket inuti fågelns huvud. Metylenkloriden, som ligger vid fågelns bas, kommer att försöka balansera trycket och flyter upp genom ett glasrör som förbinder huvudet med huvudet.
Vätskan kommer att stiga till fågelns huvud, vilket gör den tyngre och lutar sin kropp framåt. Fågeln "dricker sedan vatten" och ångtryck kommer att balansera. Balansera trycket, fågelns fågel kommer att återgå till det vertikala läget och cykeln kommer att upprepas medan huvudet avdunstar igen igen.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Walter J. Moore. (1962). Fysisk kemi. (Fjärde upplagan). Longmans.
- Wikipedia. (2020). Ång-vätska jämvikt. Hämtad från: i.Wikipedia.org
- ED Vitz et al. (5 november 2020). Ång-vätska jämvikt. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Limer Eric. (30 januari 2018). En absurd detaljerad förklaring av Dricking Bird Toy. Återhämtat sig från: popularmechanics.com
- Alicants universitet. (s.F.). Ämne 4: Beräkning av balans-vetor. Jämviktsdiagram. [Pdf]. Återhämtat sig från: rua.Ua.är

