Förklaring av kemisk balans, faktorer, typer, exempel

- 4829
- 886
- Prof. Erik Johansson
han kemisk balans Det är ett tillstånd som når de reversibla kemiska reaktionerna där ingen variation av koncentrationer eller reagens, eller av de produkter som är inblandade produceras. Det kännetecknas av att vara dynamisk och inte statisk; det vill säga molekylerna eller atomerna fortsätter att reagera, men upprätthåller samma koncentrationer under tiden.
En liknande balans presenteras också i fasändringar, även om det inte finns några länkavbrott. Till exempel kan en vätska vara i balans med sina ångor, liksom som ett fast ämne. På samma sätt skapar en solid en balans med vattnet som omger det när det har fällts ut eller kristalliseras.
 Inom den kemiska industrin är kunskap om den kemiska balansen avgörande för att få syntes med bättre utbyten. Källa: Pxhere.
Inom den kemiska industrin är kunskap om den kemiska balansen avgörande för att få syntes med bättre utbyten. Källa: Pxhere. När den kemiska balansen har upprättats är det inte möjligt att få fler förändringar eller svar såvida det inte avbryts eller påverkas av externa åtgärder. Det är således, i syntesen av en produkt, flera parametrar såsom tryck, volym eller temperatur modifieras, så att den maximala mängden produkt genereras i jämvikt.
Annars, i balans kommer mängden produkter att vara otillfredsställande; det vill säga det kommer att bli dålig reaktionsprestanda. Det är därför den kemiska balansen är avgörande för den kemiska industrin, och i allmänhet för alla syntes oavsett dess skala.
I kemisk balans kan det finnas fler produkter eller fler reagens. Allt beror på var balansen är fördrivna. Med hänsyn till flera faktorer kan du flytta en balans mot någon av de två riktningarna för den dubbla pilen i den reversibla reaktionen.
[TOC]
Förklaring av kemisk balans
Före balans
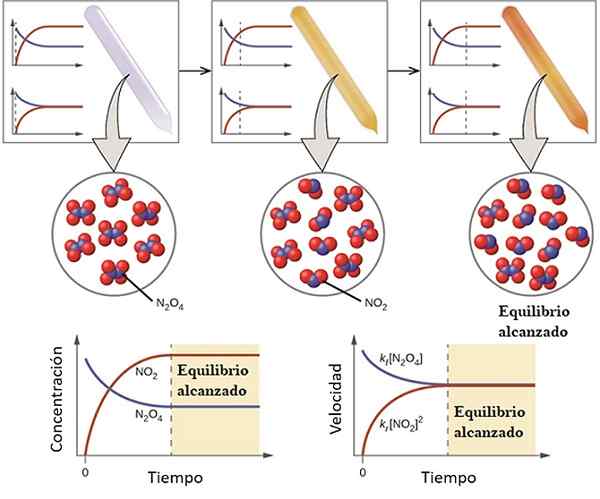 Exempel på hur en reaktion närmar sig balansen. Källa: OpenStax/CC av (https: // CreativeCommons.Org/licenser/av/4.0)
Exempel på hur en reaktion närmar sig balansen. Källa: OpenStax/CC av (https: // CreativeCommons.Org/licenser/av/4.0) För att förstå vad den kemiska balansen anser att följande reversibel reaktion:
N2ANTINGEN4(g) ⇌ nr2(g)
Gasen n2ANTINGEN4 Det är färglöst, medan gasen inte gör det2 presenterar en brun eller brun färg. Om en specifik mängd N injiceras i en liten injektionsflaska eller behållare2ANTINGEN4, Detta kommer att vara färglöst tills balansen är etablerad.
Till vänster om den övre bilden kan man se att nästan alla molekyler är av N2ANTINGEN4 och att koncentrationen av nej2 Det är noll.
Visa också två grafer som representerar hur trenden i balansen är, med den streckade linjen som pekar positionen vid den tidpunkten att endast N injiceras2ANTINGEN4. En graf motsvarar koncentration vs. Tid (nedhand) och den andra motsvarar grafen med hastighet Vs. Tid (ner till höger).
Koncentrationen av N2ANTINGEN4, [N2ANTINGEN4] (blå linje) kommer gradvis att minska, eftersom en del av den kommer att dissocieras för att producera molekyler av NO2. Således är koncentrationen av NO2, [NEJ2] (röd linje) lika med noll i början, kommer snart att öka när n2ANTINGEN4 Ta avstånd.
Det är emellertid en reversibel reaktion: en del av NO -molekylerna2 De kommer att gå med för att bilda N2ANTINGEN4. Det kommer därför att finnas två reaktioner, direkta och omvända, var och en med sina egna hastigheter.
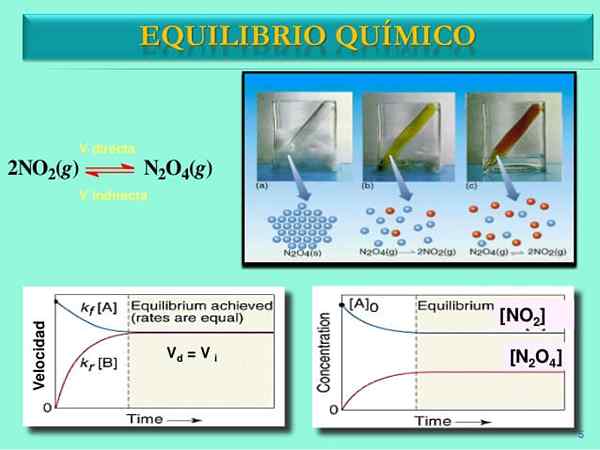 Källa: Slideshare.netto
Källa: Slideshare.netto Reaktionshastighet
Först är konsumtionshastigheten för N2ANTINGEN4 är större än konsumtionshastigheten för nej2. Uppenbarligen har du bara n2ANTINGEN4, de få molekylerna som bildas av NO2 De kan knappt befinna sig för att reagera. Vid denna tidpunkt kommer injektionsflaskan att börja sticka orange, eftersom det finns en blandning av N2ANTINGEN4 och inte2.
Lite efter lite, eftersom det finns fler molekyler av NO2 På vägen och att N -molekylerna2ANTINGEN4 De dissocierar, hastigheterna på de två reaktionerna kommer att matcha, även om koncentrationerna skiljer sig från varandra. Det vill säga nej2] tenderar att vara större än [n2ANTINGEN4], varför den röda linjen är ovanför den blåaktig linjen.
Kan tjäna dig: fysikalisk -kemiska egenskaperObservera att hastigheten blir DC/DT, det vill säga koncentrationsförändringen med avseende på tid. Det är därför de två C vs. t och V mot. t är inte identiska.
I balans
En gång paret n2ANTINGEN4-NEJ2 Ställ in balansen, hastigheterna för båda reaktionerna kommer att matchas och följande matematiska uttryck kommer att erhållas:
Vdirekt = k1[N2ANTINGEN4]
Vomvänd = k-1[NEJ2]2
Vdirekt = Vomvänd
k1[N2ANTINGEN4] = k-1[NEJ2]2
k1/k-1 = [Nej2]2/ [N2ANTINGEN4]
Keq = [Nej2]2/ [N2ANTINGEN4]
Vid denna tidpunkt kommer vägen att färgas ännu mer än brun, eftersom balansen är mer fördrivna mot bildandet av [nej2]. Det vill säga keq, Jämviktskonstanten måste vara större än 1 med hänsyn till det högre förhållandet, [nej2]2/ [N2ANTINGEN4].
I balanskoncentrationer [N2ANTINGEN4] och inte2] De förblir konstant, med båda reaktionerna som inträffar med samma hastighet: en viss mängd n är bara dissocierad2ANTINGEN4, Samma mängd kommer att produceras omedelbart på grund av reaktionen från en viss mängd nej2.
Av denna anledning sägs det att den kemiska balansen är dynamisk: molekylerna n2ANTINGEN4 och inte2 De deltar fortfarande i reaktioner även när det inte sker någon förändring i deras koncentrationer.
Och att vara lika reaktionshastigheter för båda sinnena, den röda och blåaktig linjen i grafiken V mot. t Spela på en horisontell linje.
Jämviktskonstant
Jämviktskonstanten för den tidigare reaktionen kommer alltid att vara densamma, vid en viss temperatur, oavsett hur mycket n2ANTINGEN4 injiceras i början på vägen. Detta kommer att vara så även om en blandning av N är direkt injicerad2ANTINGEN4 och inte2, sedan kvar i vila tills balansen når.
När balansen uppnås och koncentrationerna mäts [n2ANTINGEN4] och inte2], förhållandet [nej2]2/ [N2ANTINGEN4] kommer att ge samma sak till Keq För denna reaktion. Ju större det är (Keq >> 1), desto fler produkter kommer det att vara i balans. Och den mindre (keq << 1), más reactivos habrá en el equilibrio.
Koncentrationer [N2ANTINGEN4] och inte2] de kommer inte alltid. Till exempel, om små volymer injiceras i injektionsflaskan, eller om de tvärtom injiceras torrenter av dessa gaser i en reaktor, kommer mängderna att variera betydligt avsevärt. Men Keq Det kommer att förbli detsamma så länge temperaturen är densamma i båda processerna.
Keq Det är mottagligt för temperaturförändringar: Vid en högre temperatur kommer större värde att vara. Det är vid en högre temperatur i balans tenderar det att bildas fler produkter. Detta är så om inte reaktionen är exoterm, vilket kommer att förklaras i följande avsnitt.
Faktorer som påverkar kemisk balans
De faktorer som påverkar den kemiska balansen i en reversibel reaktion är: koncentration, tryck och temperatur.
- Koncentration
I en reversibel reaktion, enligt Le Chatliers princip, genom att öka koncentrationen av ett reagens kommer det att bli en förskjutning av den kemiska balansen till höger för att öka koncentrationen av reaktionsprodukterna.
Tvärtom, om en produkt läggs till reaktionen kommer den kemiska balansen att röra sig till vänster för att öka koncentrationen av reagensen. Om följande reaktion tas som ett exempel:
C (s) +o2(g) ⇌ 2 Co (g)
Genom att öka koncentrationen av reagensen (C och O2), Balansen kommer att röra sig till höger, det vill säga mot bildandet av Carbon Monoxide (CO) -produkten (CO). Men en ökning av koncentrationen av CA kommer att ge en förskjutning av balansen till vänster för att öka koncentrationen av C och O2.
Det kan tjäna dig: karbonylgrupp: egenskaper, egenskaper, nomenklatur, reaktivitet- Tryck
I en reaktion som utvecklats i gasfasen kommer en variation i volymen eller i det tryck som utövas på gaserna som är involverade i den, att ge en förändring i balansen, beroende på antalet mol i reagens och produkterna.
Om komponenterna i en reaktion (reagens och produkter) har skillnader i antalet mol involverade i en reaktion, till exempel dimeriseringen av kvävedioxid (Nej2):
2 Nej2(g) ⇌2ANTINGEN4(g)
En ökning av det tryck som utövas vid reaktionen i en gasfas, en konsekvens av en minskning eller inte av reaktionens volym, kommer att orsaka en förskjutning av den kemiska balansen till den sida som har mindre gasmullvader. I det här exemplet: Produkt n2ANTINGEN4.
Tvärtom, en minskning av trycket kommer att ge en förskjutning av balans på sidan av reaktionen som har det största antalet molens gas. I det givna exemplet kommer det att gå mot reagensen (nej2), För att motverka minskningen av trycket.
Om i en sodafasreaktion är molens mol är lika med produkternas mol, kommer förändringarna i trycket inte att påverka den kemiska balansen.
- Temperatur
Endoterm reaktion
I en endoterm reaktion kan värme betraktas som ett reagens, eftersom dess tillförsel är nödvändig för att reaktionen ska inträffa:
A +Q ⇌ B
Q = levererad värme
Därför, i en endoterm reaktion när temperaturen ökar, kommer balansen att röra sig till höger. Under tiden, när temperaturen minskar, rör sig balansen till vänster.
Värmen är en del av reagensen för att konsumera den för att förvandlas till B.
Exoterm reaktion
I en exoterm reaktion genereras värme, detta är en produkt av reaktionen:
A ⇌ B +Q
I en exoterm reaktion när temperaturen ökar kommer balansen att röra sig till vänster (reagens), eftersom värmeproduktionen ökar. Under tiden, när temperaturen minskar, kommer balansen att röra sig till höger (produkter).
Värmen är en del av produkterna, när temperaturen ökar kommer det inte att behöva bidra mer värme till miljön. Och därför kommer balansen att försöka dra nytta av extra värme för att producera fler reagens; I detta fall mer än.
Kemiska balanstyper
Beroende på reaktionskomponenternas fysiska tillstånd kan kemisk balans vara homogen eller heterogen.
Homogen balans
I denna typ av balans, Allt Reagens och produkter har samma fas eller vätskestatus. Till exempel:
N2(g) +3 h2(g) ⇌ 2 nH3(g)
Här är så2, som h2 och NH3 De är gasformiga ämnen.
Heterogen balans
Finns när inte alla Reagens och produkter har samma fas eller fysiskt tillstånd. Till exempel:
2 nahco3(S) ⇌ na2Co3(s) +co2(g) +h2O (g)
Här har vi nahco3 och na2Co3 som fasta ämnen och CO2 och h2Eller som gaser eller ångor.
Exempel på kemisk balans
Dissociation av ättiksyra i vatten
Ättiksyra, cho3COOH, dissocierar i vatten som upprättar en balans:
Ch3COOH (ac) + h2Eller (l) ⇌ Cho3Kuttra-(Ac) + h3ANTINGEN+(Ac)
Reaktion vars jämviktskonstant kallas surhetskonstant.
Isomeriseringantingenn av butanen
Gasen n-Butano kan isomeriseras enligt följande reversibla reaktion för att producera isomeren:
Ch3Ch2Ch2Ch3(g) ⇌ Cho3Ch (ch3)2(g)
Kväveoxidbildning i atmosfären
I atmosfären kan kväveoxid bildas, även om det är mycket knappt, från kväve och luftsyre:
N2(g) + eller2(g) ⇌ 2no (g)
Det kan tjäna dig: vad är miliequivalente? (Beräkningsexempel)K: teq Från denna reaktion är 2 · 10-31 vid 25 ºC, så en föraktlig mängd NO kommer att bildas.
ReaktionantingenN av silverdonduktion med amonYoVäxelström
Silverjoner, Ag+, De kan slutföras med ammoniak enligt följande reversibla reaktion:
Ag+(Sol) + 2nh3(L) ⇌ [AG (NH3)2]+(Sol)
Löst övningar
Övning 1
Vilken typ av kemisk jämvikt motsvarar följande reaktion?
2nocl (g) ⇌ 2no (g) + cl2(g)
Denna reaktion motsvarar en homogen jämvikt, eftersom alla ämnen involverade, NOCL, NO och CL2, De är gaser.
Övning 2
För samma reaktion från ovan, vilken förändring i balans kunde förväntas om trycket plötsligt ökade?
Låt oss räkna reagensmullarna:
2nocl
Vi har 2 mol NOCL. Låt oss nu berätta för produkternas mol:
2no + cl2
Vi har tre mol: två av nej och en av CL2. Det finns fler gasformiga mol på sidan av produkterna. Därför kommer en ökning av trycket att få balansen att röra sig till vänster, mot bildandet av NOCL. På detta sätt försöker systemet att mjukgöra effekterna av tryck som gynnar bildningen av NOCL och inte av NO och CL2.
Övning 3
För samma reaktion från ovan, anta att en betydande volym av CL plötsligt injiceras2. Vad som händer för att balansera?
När du lägger till CL2 till reaktorn eller behållaren ökar dess koncentration som en produkt av reaktionen. Och därför kommer balansen att gå tillbaka till vänster för att bilda mer NOCL.
Övning 4
Om dissociationen av NOCL vid 227 ºC har en 4 -jämviktskonstant på 4.5 · 10-4, Vilken riktning fördrivs balansen?
Igen, att vara keq Mindre än 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, Eftersom det är förskjutet till vänster.
Övning 5
Enligt följande reaktion i balans:
[CO (OH2)6]2+(AC) +4cl-(Ac) +q ⇌ [cocl4]2-(Ac) +6h2Eller (l)
Och att veta att komplexet [CO (oh2)6]2+ Det är rosa, och att komplexet är [cocl4]2- Det är blåaktig, vilka förändringar skulle du förvänta dig att se om du värmer en behållare med [CO (OH2)6]2+? Vad skulle du förvänta dig att se om jag efter uppvärmning av behållaren skulle placera den i ett badrum med is?
Reaktionen är endoterm, eftersom den absorberar värme som ett reagens. Därför, vid uppvärmning av behållaren med [CO (OH2)6]2+, Balansen kommer att röra sig till höger, mot bildandet av [cocl4]2-. En blåaktig rosa färgförändring kommer att vara.
Sedan, om den blåaktiga färgbehållaren med [cocl4]2- Det placeras i ett badrum med is, reaktionen kommer nu att röra sig till vänster, mot bildandet av CO (OH2)6]2+:
[Cocl4]2-(Ac) +6h2Eller (l) ⇌ [CO (OH2)6]2+(AC) +4cl-(Ac) +q
Detta beror på att den omvända reaktionen är exoterm och har värmen som som en produkt. Därför, vid kylning av behållaren med [cocl4]2- Blå, komplexet [CO (OH (OH2)6]2+, Och den rosa färgen kommer att dyka upp igen.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Emedical Prep. (s.F.). Typer av balans. Återhämtat sig från: emedicprep.com
- Lumengränslös kemi. (s.F.). Faktorer som apfect kemisk balans. Återhämtat sig från: kurser.Lumenarning.com
- Wikipedia. (2020). Kemisk balans. Hämtad från: i.Wikipedia.org
- Kemi librettexts. (24 maj 2020). EquiBibrium -beräkningar - Sub Illustrativa exemplar. Återhämtad från: kem.Librettexts.org
- Meyers Amy. (2020). Jämvikt: kemisk och dynamisk. Studie. Återhämtat sig från: studie.com
- Helmestine, Anne Marie, PH.D. (11 februari 2020). Kemisk balans i kemiska reaktioner. Återhämtat sig från: tankco.com
- « Guatemala kulturer egenskaper, traditioner och seder
- Grundelektrofores, teknik, vad är det för, exempel »

