Absorptionsspektrum

- 4201
- 172
- Anders Larsson
 Synligt ljusspektrum. Källa: Wikimedia Commons
Synligt ljusspektrum. Källa: Wikimedia Commons Vad är ett absorptionsspektrum?
En Absorptionsspektrum Det är produkten av interaktion mellan ljus med ett material eller ett ämne i något av dess fysiska tillstånd. Interaktionen inkluderar ett brett segment av intervallet av våglängder och energi i elektromagnetisk strålning.
Med andra ord återspeglar absorptionsspektrumet den bråkdel av elektromagnetisk strålning som ett visst material absorberar i ett frekvensområde.
I detta avseende kan vissa fasta ämnen, vätskor eller gaser absorbera fotoner av olika energier eller våglängder, från ultraviolett strålning, följt av synligt ljus, strålning eller infraröd ljus, svindlande i mikrovågsvåglängderna.
Det mänskliga ögat uppfattar bara interaktioner mellan materien med synligt ljus. Det kan också fundera över diffraktionen av vitt ljus genom ett prisma eller ett medium i dess färgglada komponenter (överlägsen bild).
Om ljusstrålen är "fångst" efter att ha rest genom ett material och analyserat, skulle frånvaron av vissa färgade band hittas. Det vill säga, svarta ränder skulle observeras kontrasterande med dess bakgrund.
Detta är absorptionsspektrumet, och dess analys är grundläggande i instrumentell analytisk kemi och astronomi.
Atomabsorption
I den övre bilden visas ett typiskt absorptionsspektrum av elementen eller atomerna. Observera att svarta ränder representerar de absorberade våglängderna, medan de andra släpps ut. Detta innebär att tvärtom, ett atomsändningsspektrum skulle se ut som ett svart band med utsända färger.
Men vad är dessa ränder? Hur man vet om atomer absorberar eller avger (utan att införa fluorescens eller fosforescens)? Svaren finns i de elektroniska tillstånden som tillåts av atomer.
Kan tjäna dig: Minsta formel: Hur man får minsta formel, exempel och övningarElektroniska övergångar och energi
Elektronerna kan röra sig bort från kärnan och lämnar den positivt laddad när du reser från en lägre energiomlopp till en av större energi. För att göra detta, förklaras av kvantfysik, absorbera fotoner av specifik energi för att utföra nämnda elektroniska övergångar.
Därför kvantiseras energi och kommer inte att absorbera medium eller tre fjärdedelar av en foton, utan frekvensvärden (v) eller betongvåglängder (λ).
När elektronen är upphetsad förblir den inte obegränsad i det elektroniska tillståndet för större energi. Släpp energi i form av en foton, och atomen återgår till sitt basala eller ursprungliga tillstånd.
Beroende på om absorberade fotoner registreras kommer det att finnas ett absorptionsspektrum. Och om de utfärdade fotonerna registreras kommer resultatet att vara ett emissionspektrum.
Detta fenomen kan observeras experimentellt om mjuka eller atomiserade prover värms upp från ett element. I astronomi, jämfört med dessa spektra, kan sammansättningen av en stjärna vara känd, och till och med dess plats relaterad till jorden.
Synligt spektrum
Som framgår av bilden inkluderar det synliga spektrumet färger från violet till rött och alla dess nyanser med avseende på hur mycket materialet absorberar (mörka nyanser).
Våglängderna för det röda ljuset motsvarar värden på 650 nm och framåt (tills de försvinner i infraröd strålning).
Och till vänster ändar de violetta och lila tonerna våglängdsvärdena upp till 450 nm. Det synliga spektrumet täcker sedan från 400 till cirka 700 nm.
När λ ökar minskar fotonens frekvens och därför dess energi. Således har violett ljus större energi (lägre våglängder) än rött ljus (högre våglängder).
Kan tjäna dig: brom: historia, struktur, elektronisk konfiguration, egenskaper, användningarDärför innebär ett material som absorberar lila ljus elektroniska övergångar av större energier.
När materialet absorberar den violetta färgen kommer det att ha en grönaktig gul färg, vilket innebär att dess elektroner utför mycket energiövergångar. Och när materialet absorberar den röda färgen, med mindre energi, kommer det att återspegla en blåaktig grön färg.
När en atom är mycket stabil presenterar den vanligtvis mycket avlägsna elektroniska tillstånd i energi och kommer därför att behöva absorbera fotoner med större energi för att möjliggöra elektroniska övergångar:
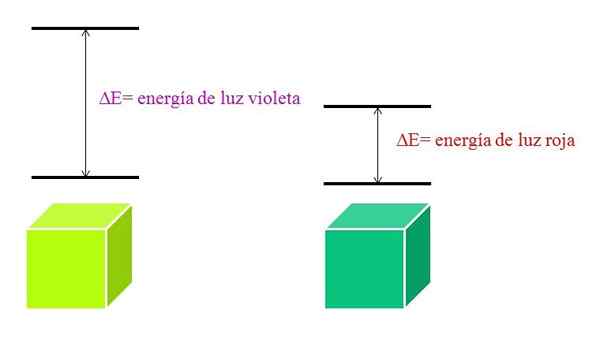 Schema för energier av violett och rött ljus. Källa: Gabriel Bolívar
Schema för energier av violett och rött ljus. Källa: Gabriel Bolívar Molekyler absorptionsspektrum
Molekylerna har atomer, och dessa absorberar också elektromagnetisk strålning. Men deras elektroner är en del av den kemiska bindningen, så deras övergångar är olika. En av de stora triumferna för molekylär orbital teori är att kunna relatera absorptionsspektra till den kemiska strukturen.
Således har enkla, dubbla, trippel, konjugerade länkar och aromatiska strukturer sina egna elektroniska tillstånd och absorberar mycket specifika fotoner.
Genom att ha flera atomer, utöver de intermolekylära interaktioner och vibrationerna i deras länkar (som också absorberar energi), har molekyler absorptionsspektra formen av "berg", som indikerar de band som inkluderar våglängderna där elektroniska övergångar.
Tack vare dessa spektra kan en förening karakteriseras, identifiera och till och med genom multivariat analys, kvantifiera den.
Metylenblå
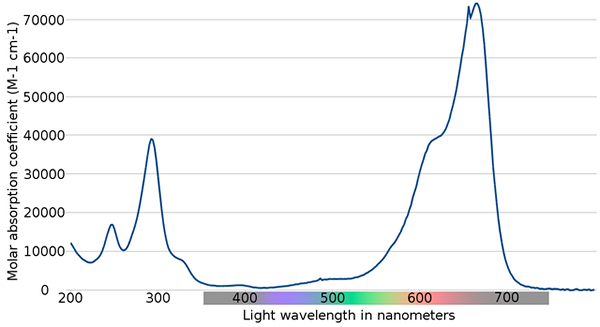 Metylenblå spektrum. Källa: Wikimedia Commons
Metylenblå spektrum. Källa: Wikimedia Commons I den övre bilden visas spektrumet för den blå metylenindikatorn. Som namnet påpekar är det blått, men kan det kontrolleras med dess absorptionsspektrum?
Kan tjäna dig: fysiska förändringarObservera att det finns band mellan våglängderna 200 och 300 nm. Mellan 400 och 500 nm finns det nästan ingen absorption, det vill säga den absorberar inte de violetta, blå eller gröna färgerna.
Det presenterar emellertid ett intensivt absorptionsband efter 600 nm, och har därför låg -energi elektroniska övergångar som absorberar foton med rött ljus.
Följaktligen, och med tanke på de höga värdena på molära absorber, uppvisar metylenblå en intensiv blå färg.
Klorofiler A och B
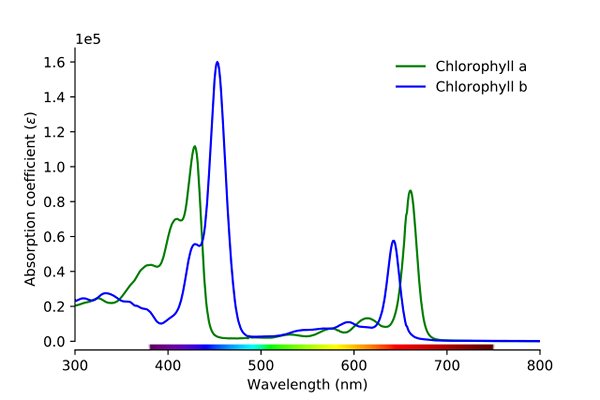 Klorofyllabsorptionsspektrum A och B. Källa: Wikimedia Commons
Klorofyllabsorptionsspektrum A och B. Källa: Wikimedia Commons Som framgår av bilden motsvarar den gröna linjen klorofyll ett absorptionsspektrum, medan den blå linjen motsvarar den för klorofyll B.
Först de band där molära absorber är högre, i detta fall de som är till vänster, mellan 400 och 500 nm. Klorofyll En intensivt absorberande lila färger, medan klorofyll B (blå linje) gör det med blå färg.
Genom att absorbera klorofyll B runt 460 nm (blå) reflekteras gul färg. Å andra sidan absorberar den också intensivt, cirka 650 nm, orange ljus, vilket innebär att den visar färgen blå. Om gult och blått är blandat, resulterar det i grön färg.
Och slutligen, klorofyll A absorberar den blåaktiga violetta färgen, och också ett rött ljus runt 660 nm. Därför uppvisar den en grön "mjuk" färg med gul.
Referenser
- Observatoire de Paris (S.F.). De olika typerna av spektra. Hämtad i genomsnitt4.Osppm.fr
- Ranals University Campus (s.F.). Spektrofometri: Absorptionsspektra och kolorimetrisk kvantifiering av biomolekyler. UCO återhämtade sig.är

