Litiumfluoridstruktur, egenskaper, erhållning, användning

- 3384
- 268
- PhD. Emil Svensson
han Litiumfluorid Det är ett oorganiskt fasta ämnen vars kemiska formel är liv. Bildas av li -joner+ och f- som är förenade genom en jonisk bindning. Det finns i små mängder i flera mineraler, särskilt silikater som lepidolit, havsvatten och i många mineralbrunnar.
Det har haft stor användning på optiska enheter på grund av dess transparens i ett brett spektrum av våglängder, från det infraröda spektrumet (IR) till UV -ultraviolet, genom det synliga.
 Lepidolit, mineral som innehåller små mängder livlig fluorid. Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Lepidolit, mineral som innehåller små mängder livlig fluorid. Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Det har också använts på enheter för att upptäcka farlig strålning i jobb där människor utsätts för dessa under en kort tid. Dessutom används det som material för att smälta aluminium eller för att göra glas eller glasglas och keramisk tillverkning.
Det fungerar som material för att täcka litium -jion -batterikomponenter och för att förhindra den första förlusten av belastning av dessa.
[TOC]
Strukturera
Litiumfluorid är en jonisk förening, det vill säga bildad av föreningen av li -katjonen+ och anjonen f-. Kraften som håller dem ihop är elektrostatisk och kallas jonbindning.
När litium kombineras ger han en elektron till fluor, båda är mer stabila än det första sättet, som förklaras nedan.
Litiumelementet har följande elektroniska konfiguration: [han] 1s2 2s1 Och när du ger en elektron är den elektroniska strukturen så här: [han] 1s2 vilket är mycket mer stabilt.
Fluorelementet vars elektroniska konfiguration är: [ne] 1s2 2s2 2 p5, Genom att acceptera elektronen är formen [ne] 1s2 2s2 2 p6, stabilare.
Nomenklatur
- Litiumfluorid
- Fluorolitio
Kan tjäna dig: icke -metalliska oxider- Litiummonofluorid
Egenskaper
Fysiskt tillstånd
Vitt fast ämne, som kristalliseras i kubisk struktur, såsom natriumklorid NaCl.
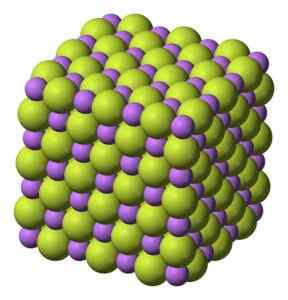 Kubisk struktur av liv litiumfluoridkristaller. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Kubisk struktur av liv litiumfluoridkristaller. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Molekylvikt
26 g/mol
Smältpunkt
848.2 ºC
Kokpunkt
1673 ºC, även om den är förångad vid 1100-1200 ºC
Densitet
2 640 g/cm3
Brytningsindex
1 3915
Löslighet
Lite lösligt i vatten: 0,27 g/100 g vatten vid 18 ºC; 0,134 g/100 g vid 25 ºC. Löslig i surt medium. Olöslig i alkohol.
Andra egenskaper
Dess ångor har dimic arter (LIF)2 och trimerisk (LIF)3. Med HF fluorhorhorinsyra bildar lihf litium2; Med litiumhydroxid bildar det ett dubbelt livssalt.Lioh.
Att få och plats
LIF -litiumfluorid kan erhållas genom reaktion mellan HF -fluorhorinsyra och lih litiumhydroxid eller litium litiumkarbonat2Co3.
Det finns emellertid i små mängder i vissa mineraler som lepidolit och havsvatten.
 Litiumfluor finns i små mängder i havsvatten. Adeeb atwan [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]. Källa: Wikimedia Commons.
Litiumfluor finns i små mängder i havsvatten. Adeeb atwan [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]. Källa: Wikimedia Commons. Ansökningar
I optiska applikationer
LIF används i form av kompakta kristaller i infraröda spektrofotometrar (IR) på grund av den utmärkta dispersion de har i våglängdsintervallet mellan 4000 och 1600 cm-1.
Lif Lif -kristaller erhålls från mättade lösningar från detta salt. Det kan ersätta naturliga fluoritkristaller i olika typer av optiska enheter.
Stora och rena kristaller används i optiska system för ultraviolett ljus (UV), synliga och IR- och röntgenmonokromatorer (0,03-0,38 nm).
 Life Lif Fluoruro Crystal, inuti en bägare. V1adis1av [public domain]. Källa: Wikimedia Commons.
Life Lif Fluoruro Crystal, inuti en bägare. V1adis1av [public domain]. Källa: Wikimedia Commons. Det används också som optiskt beläggningsmaterial för UV -regionen på grund av dess breda optiska band, större än för andra metallfluorider.
Det kan tjäna dig: alkalinoterösa metallerHans transparens i den avlägsna UV (90-200 nm) gör den idealisk som en skyddande beläggning i aluminiumspeglar (AL). LIF/AL -speglar har användning i optiska teleskopsystem för rymdapplikationer.
Dessa beläggningar uppnås genom fysisk avsättning av ång- och skiktavsättning på atomnivå.
I joniserande eller farliga strålningsdetektorer
Litiumfluorid har använts allmänt i termoluminescerande detektorer för fotoner, neutron och ß (beta) strålning.
Termoluminescerande detektorer håller strålningsenergin när de utsätts för detta. Därefter när de värmer dem släpper energin lagrad i lätt form.
För denna applikation är LIF i allmänhet daterad med magnesiumföroreningar (MG) och titan (TI). Dessa föroreningar genererar vissa energinivåer som fungerar som hål där elektronerna frigörs av strålning fångas. När materialet sedan upphettas återgår dessa elektroner till sitt ursprungliga energitillstånd som släpper ut ljus.
Det utsända ljusets intensitet beror direkt på energin som absorberas av materialet.
Termoluminescerande detektorer av LIF har testats framgångsrikt för att mäta komplexa strålningsfält, såsom de som finns i Large Hadron Collider, eller LHC (för dess förkortning för engelska Stor hadron collider), beläget i den europeiska organisationen för kärnkraftsforskning, känd som CERN (för sin akronym av franska Conseil Européen häll Recherche Nucleaire).
Strålning i de erfarenheter som utförs i det forskningscentret är närvarande hadroner, neutroner och elektroner/positroner, bland andra typer av subatomära partiklar, som alla kan upptäckas med LIF.
Som material för att prelite litiumbatteriets katod
LIF har testats framgångsrikt i form av nanokompositer med kobolt (CO) och järn (tro) som material för prelitiering (översättning av engelska Prelitering) av litium -jion batterikatodmaterialet.
Kan tjäna dig: etyleterUnder den första belastningscykeln eller formationssteget för ett litiumjonbatteri bryts den organiska elektrolyten ned för att bilda en fast fas på anodens yta.
Denna process konsumerar litium av katoden och minskar energi mellan 5 till 20% av den totala kapaciteten för litiumjonbatteriet.
Av detta skäl har den elektrokemiska prelitationen av katoden undersökts, vilket genererar en elektrokemisk extraktion av litium hos nanokompositionen, som fungerar som en litiumdonator, och därmed undviker konsumtionen av litium i katodens katod.
Nanokompositer LIF/CO och LIF/FE har en hög kapacitet att donera litium till katoden, vara lätt att syntetisera, stabila i miljö- och batteribehandlingsförhållanden.
 Litium jon batteri. Författare: Mr.ちゅら ちゅら. LITHIUM_BATTERY * FOTOGRAFIDAG, augusti 2005 * Fotografering Person ANEY. Källa: Wikimedia Commons.
Litium jon batteri. Författare: Mr.ちゅら ちゅら. LITHIUM_BATTERY * FOTOGRAFIDAG, augusti 2005 * Fotografering Person ANEY. Källa: Wikimedia Commons. I flera användningsområden
Litiumfluorid används som en svetsmätare, särskilt aluminium och i svetsstångbeläggningar. Det används också i aluminiumreduktionsceller.
Det används allmänt vid tillverkning av glas (till exempel linserna) där expansionskoefficienten minskar. Det används också i keramiktillverkning. Dessutom har den användning vid tillverkning av emaljer och glasartiklar.
LIF är en bränslekomponent för raketer och bränslen för vissa typer av reaktorer.
LIF används också i ljusemitterande dioder eller fotovoltaiska komponenter, för injektion av elektroner i inre skikt.
Referenser
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- ELLER.S. National Library of Medicine. (2019). Fluoridium. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov.
- Obryk, b. et al. (2008). Svaret från olika typer av TL-litiumfluoriddetektorer på höganergi blandade strålningsfält. Strålmätningar 43 (2008) 1144-1148. Återhämtat sig från Scientedirect.com.
- Sol och. et al. (2016). I situal kemisk syntes av litiumfluorid/metall nanokomposit för hög kapacitet Prelitiering av katoder. Nano Letters 2016, 16, 2, 1497-1501. Återhämtat sig från pubar.ACS.org.
- Hennessy, J. och Nikzad, s. (2018). Atomlager avsättning av litiumfluoridoptiska beläggningar för ultraviolett. Inorganics 2018, 6, 46. MDPI återhämtade sig.com.
- « 10 vetenskapliga experiment för fysisk sekundär, kemi, biologi
- Metylmalonsyrastruktur, egenskaper, syntes, användningar »

